题目内容
对于任何一个化学平衡体系,以下变化或采取的措施,平衡一定发生移动的是
①加入一种反应物,②增大体系的压强,③升高温度,④使用催化剂,⑤化学平衡常数减小.
A.①②③⑤ B.①②③④⑤
C.③⑤ D.①②③
练习册系列答案
相关题目
14.表为元素周期表的一部分.
回答下列问题
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素的原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成8.5gX的最高价化合物,恢复至室温,放热34.35kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)碳与铝形成的1mol化合物Q与水反应,生成4molAl(OH)3和3mol化合物L(仅含碳、氢两种元素),则L的电子式为 .
.
(6)H2Y2是实验室中的常用试剂,其结构中存在的共价键有和,在制备过程中要防止Fe3+的混入,理由是铁离子对过氧化氢分解起到催化剂作用,.
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素的原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成8.5gX的最高价化合物,恢复至室温,放热34.35kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)碳与铝形成的1mol化合物Q与水反应,生成4molAl(OH)3和3mol化合物L(仅含碳、氢两种元素),则L的电子式为
 .
.(6)H2Y2是实验室中的常用试剂,其结构中存在的共价键有和,在制备过程中要防止Fe3+的混入,理由是铁离子对过氧化氢分解起到催化剂作用,.
12.下列热化学方程式书写正确的是( )
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ/mol | |
| B. | 2SO2+O2?2SO3;△H=-196.6 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6 kJ | |
| D. | C(s)+O2(g)═CO2(g);△H=+393.5 kJ/mol |


 bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
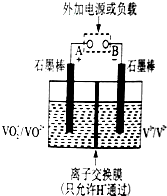 钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用.回答下列问题:
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用.回答下列问题: