题目内容
NA为阿伏加德罗常数,下列叙述正确的是( )
A、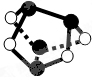 0.5mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S-S键 |
| B、用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属 |
| C、1mol过氧化氢分子中共用电子对数为3NA |
| D、0.1mol Na2CO3?10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.由图可知雄黄分子中只存在As-S键,不存在S-S键;
B.银离子氧化性强于铜离子,先放电;
C一个过氧化氢分子中含有1个O-O和2个H-O键,共用3对电子;
D.0.A1mol Na2CO3?10H2O在晶体中含有0.1mol碳酸根离子.
B.银离子氧化性强于铜离子,先放电;
C一个过氧化氢分子中含有1个O-O和2个H-O键,共用3对电子;
D.0.A1mol Na2CO3?10H2O在晶体中含有0.1mol碳酸根离子.
解答:
解:A.由图可知雄黄分子中只存在As-S键,不存在S-S键,故A错误;
B.银离子氧化性强于铜离子,所以阴极上银先析出,当有0.2 NA个电子转移时,阴极析出2.16g银,故B错误;
C.一个过氧化氢分子中含有1个O-O和2个H-O键,共用3对电子,所以1mol过氧化氢分子中共用电子对数为3NA,故C正确;
D.0.A1mol Na2CO3?10H2O在晶体中含有0.1mol碳酸根离子,故D错误;
故选:C.
B.银离子氧化性强于铜离子,所以阴极上银先析出,当有0.2 NA个电子转移时,阴极析出2.16g银,故B错误;
C.一个过氧化氢分子中含有1个O-O和2个H-O键,共用3对电子,所以1mol过氧化氢分子中共用电子对数为3NA,故C正确;
D.0.A1mol Na2CO3?10H2O在晶体中含有0.1mol碳酸根离子,故D错误;
故选:C.
点评:本题考查了阿伏伽德罗常数的应用,题目难度不大,注意看清雄黄分子结构中所含的化学键是解题关键.

练习册系列答案
相关题目
煤、石油、天然气是当今世界上最重要的化石燃料,下列关于它们的描述不正确的是( )
| A、燃烧时都会放出热量 |
| B、都是混合物 |
| C、都是重要的化工原料 |
| D、都是可再生能源 |
下列说法不正确的是( )
| A、可通过酸性高锰酸钾溶液来区别烯烃和炔烃 |
| B、乙烯是石油裂解后的产物 |
| C、石油的分馏是物理变化,煤的干馏是化学变化 |
| D、现代工业生产中芳香烃主要来源于石油化工的催化重整和裂化 |
下列分散系不能发生丁达尔现象的是( )
| A、石灰水 | B、含有尘埃的空气 |
| C、雾 | D、彩色玻璃 |
中学化学中有许多规律,下列说法正确的是( )
| A、由卤族元素性质变化规律,类推同主族元素自上而下单质熔沸点一定是由低到高 |
| B、利用复分解反应以强制弱规律,弱酸一定不能制强酸 |
| C、能和碱反应生成盐和水的氧化物一定是非金属氧化物 |
| D、有单质参加和生成的反应不一定是氧化还原反应 |
 如图是模拟铁的电化学防护装置.以下叙述正确的是( )
如图是模拟铁的电化学防护装置.以下叙述正确的是( )| A、此装置属于电解池 |
| B、此装置中的铁极上发生氧化反应 |
| C、该电化学防护法称为“牺牲阳极阴极保护法” |
| D、该电化学防护法称为“外加电源阴极保护法” |
下列化学用语正确的是( )
| A、Fe2(SO4)3与氨水反应:Fe3++3OH-=Fe(OH)3↓ |
| B、NaHCO3溶解于水电离:NaHCO3?Na++H++CO32- |
| C、NaHS的水解:HS-+H2O?H2S+OH- |
| D、Na2SO3的水解:SO32-+2H2O?H2SO3+2OH- |
 在容积一定的密闭容器中发生可逆反应A(g)+2B(g)?2C(g)-Q,条件变化时,影响平衡移动的关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应A(g)+2B(g)?2C(g)-Q,条件变化时,影响平衡移动的关系如图所示.下列说法正确的是( )| A、P1<P2,纵坐标指A的质量分数 |
| B、P1>P2,纵坐标指C的质量分数 |
| C、P1<P2,纵坐标指混合气体的平均摩尔质量 |
| D、P1>P2,纵坐标指A的转化率 |
下列离子方程式中正确的是( )
| A、Al(OH)3滴加稀盐酸:OH-+H+=H2O |
| B、Fe片浸泡在FeCl3溶液中:Fe3++Fe=2Fe2+ |
| C、MgCl2溶液中滴加氨水:Mg2++2OH-=Mg(OH)2↓ |
| D、NaHSO4溶液中加BaCl2溶液:SO42-+Ba2+=BaSO4↓ |