题目内容
 如图是模拟铁的电化学防护装置.以下叙述正确的是( )
如图是模拟铁的电化学防护装置.以下叙述正确的是( )| A、此装置属于电解池 |
| B、此装置中的铁极上发生氧化反应 |
| C、该电化学防护法称为“牺牲阳极阴极保护法” |
| D、该电化学防护法称为“外加电源阴极保护法” |
考点:金属的电化学腐蚀与防护,原电池和电解池的工作原理
专题:电化学专题
分析:A、电解池具有外加电源;
B、原电池的正极上发生还原反应;
C、原电池的正极被保护的方法称为“牺牲阳极阴极保护法”;
D、电解池的阴极被电化学防护法称为“外加电源阴极保护法”.
B、原电池的正极上发生还原反应;
C、原电池的正极被保护的方法称为“牺牲阳极阴极保护法”;
D、电解池的阴极被电化学防护法称为“外加电源阴极保护法”.
解答:
解:A、电该不具有外加电源不是电解池,属于原电池,故A错误;
B、该装置中,金属铁是原电池的正极,铁极上发生还原反应,故B错误;
C、装置中金属铁是原电池的正极,原电池的正极被保护的方法称为“牺牲阳极阴极保护法”,故C正确;
D、装置中金属铁是原电池的正极,原电池的正极被保护的方法称为“牺牲阳极阴极保护法”,做电解池的阴极的金属被防护法称为“外加电源阴极保护法”,故D错误.
故选C.
B、该装置中,金属铁是原电池的正极,铁极上发生还原反应,故B错误;
C、装置中金属铁是原电池的正极,原电池的正极被保护的方法称为“牺牲阳极阴极保护法”,故C正确;
D、装置中金属铁是原电池的正极,原电池的正极被保护的方法称为“牺牲阳极阴极保护法”,做电解池的阴极的金属被防护法称为“外加电源阴极保护法”,故D错误.
故选C.
点评:本题考查学生原电池的构成条件以及金属的防护方法,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
Harbermann等设计出利用Desulfovibrio desulfurcan菌种生成的硫化物作为介体的微生物燃料电池,电池内部有质子(即H+)通过,该系统不经任何维护可连续运行5年.该电池的负极反应式为S2-+4H2O-8e-=SO42-+8H+.下列说法中正确的是( )
| A、若有1.12 L氧气参与反应,则有0.2 mol电子发生转移 |
| B、质子由正极移向负极 |
| C、该电池的总反应为S2-+2O2=SO42- |
| D、正极的电极反应式为2O2+8e-+4H2O=8OH- |
用下列实验装置完成对应的实验,能达到实验目的是( )
A、 构成钢管原电池 |
B、 比较NaHCO3和Na2CO3的热稳定性 |
C、 吸收多余的NH3 |
D、 配制银氨溶液 |
下列各组离子中,在给定条件下能大量共存的是( )
| A、在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
| B、有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- |
| C、有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| D、在c(H+)=1.0×10-13mol?L-1的溶液中:Na+、S2-、[Al(OH)4]-、SO32- |
NA为阿伏加德罗常数,下列叙述正确的是( )
A、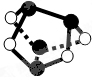 0.5mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S-S键 |
| B、用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属 |
| C、1mol过氧化氢分子中共用电子对数为3NA |
| D、0.1mol Na2CO3?10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
关于下列图示的说法中正确的是( )
A、 如图两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
B、 用如图所示实验装置排空气法收集CO2气体 |
C、 如图表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H>0 |
D、 用图所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
常温下,柠檬水溶液的PH是3,其中的C(OH-)是( )
| A、0.1mol/L |
| B、1.0×10-3 mol/L |
| C、1.0×10-11mol/L |
| D、1.0×10-7mol/L |
下列酸放置烧杯一段时间后质量会增加的是( )
| A、稀H2SO4 |
| B、浓HNO3 |
| C、浓HCl |
| D、浓H2SO4 |
下列有关化学用语表示正确的是( )
| A、乙烯的结构简式:C2H4 | ||
B、中子数为20的钾原子:
| ||
| C、次氯酸的结构式:H-O-Cl | ||
| D、氯化钠的分子式为:NaCl |