题目内容
中学化学中有许多规律,下列说法正确的是( )
| A、由卤族元素性质变化规律,类推同主族元素自上而下单质熔沸点一定是由低到高 |
| B、利用复分解反应以强制弱规律,弱酸一定不能制强酸 |
| C、能和碱反应生成盐和水的氧化物一定是非金属氧化物 |
| D、有单质参加和生成的反应不一定是氧化还原反应 |
考点:化学的主要特点与意义,化学反应的基本原理
专题:物质的性质和变化专题
分析:A.金刚石的熔沸点比晶体硅的高;
B.弱酸与盐溶液如果满足复分解条件也可能生成强酸;
C.能和碱反应生成只盐和水的氧化物是酸性氧化物;
D.氧气和臭氧之间的转化没有元素的化合价变化.
B.弱酸与盐溶液如果满足复分解条件也可能生成强酸;
C.能和碱反应生成只盐和水的氧化物是酸性氧化物;
D.氧气和臭氧之间的转化没有元素的化合价变化.
解答:
解:A.金刚石的熔沸点比晶体硅的高,不一定是由低到高,故A错误;
B.弱酸与盐溶液如果满足复分解条件也可能生成强酸,如CuSO4+H2S═CuS↓+H2SO4,故B错误;
C.酸性氧化物也可能是金属氧化物,如:Mn2O7是酸性氧化物,故C错误;
D.氧气和臭氧之间的转化有单质参加的反应,但该反应不是氧化还原反应,故D正确.
故选D.
B.弱酸与盐溶液如果满足复分解条件也可能生成强酸,如CuSO4+H2S═CuS↓+H2SO4,故B错误;
C.酸性氧化物也可能是金属氧化物,如:Mn2O7是酸性氧化物,故C错误;
D.氧气和臭氧之间的转化有单质参加的反应,但该反应不是氧化还原反应,故D正确.
故选D.
点评:本题考查了常见物质的性质,熟练掌握物质的性质,是解决此类问题的关键,正确运用物质分类及反应规律则是解决此类问题的有效方法.

练习册系列答案
相关题目
下列有关试纸的使用及实验现象的叙述正确的是( )
| A、用干燥洁净玻璃棒蘸取溶液点在pH试纸上,跟标准比色卡比较确定该溶液pH |
| B、使湿润的淀粉碘化钾试纸变蓝的气体一定是氯气 |
| C、使湿润的红色石蕊试纸褪色的气体必然是SO2 |
| D、用湿润的pH试纸测定溶液的pH,所测pH一定不准 |
某主族元素的原子,核外有五个电子层,最外层有7个电子,下列关于此元素的说法中正确的是( )
| A、其原子半径比氯的原子半径小 |
| B、其简单阴离子的还原性比Cl-强 |
| C、其单质的氧化性比Cl2强 |
| D、其氢化物的稳定性比HCl强 |
下列说法正确的是( )
| A、1mol Na与足量O2反应,钠失去NA个电子 |
| B、目前加碘食盐中主要添加的是KI |
| C、Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
| D、Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 |
某一反应物的浓度是2mol/L,经过10s后,它的浓度变成了0.5mol/L,在这10s内它的反应速率为( )
| A、0.15 |
| B、0.15mol/(L?s) |
| C、0.2mol/(L?s) |
| D、0.15mol/L |
NA为阿伏加德罗常数,下列叙述正确的是( )
A、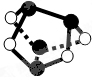 0.5mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S-S键 |
| B、用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属 |
| C、1mol过氧化氢分子中共用电子对数为3NA |
| D、0.1mol Na2CO3?10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
下列有关实验的操作及描述不正确的是( )
| A、用托盘天平称取10.5g NaCl时应在右边托盘中放入10g砝码 |
| B、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,然后与标准比色卡对照 |
下列有关溶液中微粒浓度关系正确的是( )
| A、0.1 mol/L的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、等体积、等物质的量浓度的NaOH溶液与NaHCO3溶液混合后的溶液:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| C、0.2 mol/L的某一元弱酸HA溶液和0.1 mol/LNaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
| D、常温下,NH4Cl和NH3?H2O的混合溶液[pH=7,c(Cl-)=0.1mol/L]中:c(Cl-)>c(NH4+)>c(OH-)=c(H+) |
下列说法正确的是( )
| A、发生化学变化则一定伴有能量变化 |
| B、有能量变化则一定发生化学变化 |
| C、1mol碳燃烧所放出的热量一定叫碳的燃烧热 |
| D、物质本身能量越高,该物质越稳定 |