题目内容
13. 镁粉和铝粉分别与等浓度、等体积的过量盐酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁粉和铝粉分别与等浓度、等体积的过量盐酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )| A. | 镁粉和铝粉的物质的量之比为3:2 | |
| B. | 镁粉和铝粉质量之比为3:2 | |
| C. | 镁粉和铝粉的摩尔质量之比为2:3 | |
| D. | 镁粉和铝粉反应完所需时间之比为3:2 |
分析 A.硫酸过量,Mg、Al完全反应,由图可知生成氢气体积相同,则氢气物质的量相等,假设氢气为1mol,根据电子转移守恒计算Mg、Al物质的量;
B.再根据m=nM计算质量之比;
C.摩尔质量之比等于相对原子质量之比;
D.Mg与盐酸反应速率更快.
解答 解:硫酸过量,Mg、Al完全反应,由图可知生成氢气体积相同,则氢气物质的量相等,假设氢气为1mol,根据电子转移守恒,Mg的物质的量为$\frac{1mol×2}{2}$=1mol、Al物质的量为$\frac{1mol×2}{3}$=$\frac{2}{3}$mol.
A.Mg、Al的物质的量之比为1mol:$\frac{2}{3}$mol=3:2,故A正确;
B.Mg、Al的质量之比为1mol×24g/mol:$\frac{2}{3}$mol×27g/mol=4:3,故B错误;
C.Mg、Al的摩尔质量之比为24g/mol:27g/mol=8:9,故C错误;
D.金属性Mg>Al,故Mg与盐酸反应速率更快,则镁粉和铝粉反应完所需时间之比为2:3,故D错误,
故选:A.
点评 本题以化学反应图象形式,考查化学方程式有关计算、化学反应速率等,关键是明确金属完全反应且生成氢气的体积相等,注意利用守恒法与赋值法解答.

练习册系列答案
相关题目
3.下列各个选项中的转化,不能一步完成的是( )
| A. | Na→NaOH→Na2CO3 | B. | NaCl→Cl2→Fe Cl3 | ||
| C. | CO→CO2→C | D. | Al2O3→Al(OH)3→AlCl3 |
4.下列离子方程式书写正确的是( )
| A. | 铜跟硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 盐酸与澄清石灰水反应:H++OH-═H2O |
8.下列离子方程式与所述事实相符且正确的是( )
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 碳酸氢钙与少量澄清石灰水反应:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 强碱溶液中,次氯酸钠与Fe(OH)2:3ClO-+2Fe(OH)2═2FeO42-+3Cl-+H2O+4H+ |
18.下列离子在给定条件下,一定能大量共存的是( )
| A. | 25℃时,水电离出的c(H+)=1×l0-l3 mol/L的溶液中:K+、Ba2+、NO3-、I- | |
| B. | 某无色透明的溶液中:Ca2+、NH4+、HCO3-、CH3COO- | |
| C. | 0.1 mol/L的AlCl3溶液中:Na+、K+、SO42-、S2- | |
| D. | c(H+)=$\sqrt{{K}_{W}}$的溶液中:Na+、Fe3+、CH3COO-、NO3- |
5.下列说法中不正确的是( )
| A. | 钠保存在石蜡油或煤油中 | |
| B. | 实验室盛装NaOH溶液的试剂瓶用玻璃塞 | |
| C. | 保存FeSO4溶液需加入少量铁粉 | |
| D. | 氯水保存在棕色试剂瓶中 |
2.控制适宜的条件,将反应2Fe3++2Iˉ?2Fe2++I2设计成如图所示的原电池.下列判断 错误的是( )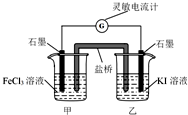

| A. | 反应开始时,乙中石墨电极上发生氧化反应 | |
| B. | 反应开始时,甲中石墨电极为正极 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 |
3.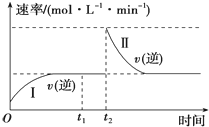 在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )
在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )
 在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )
在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )| A. | 0~t2时,v(正)>v(逆) | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ=Ⅱ | |
| C. | t2时刻改变的条件是向密闭容器中加C | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数K(Ⅰ)=K(Ⅱ) |