题目内容
有A、B、D、E、F、G六种前四周期的元素,A是宇宙中最丰富的元素,B和D的原子都有1个未成对电子,B+比D少一个电子层,D原子得一个电子填入3p轨道后,3p轨道全充满;E原子的2p轨道中有3个未成对电子,F的最高化合价和最低化合价的代数和为4.R是由B、F两元素形成的离子化合物,其中B+与F2-离子数之比为2:1.G位于周期表第6纵行且是六种元素中原子序数最大的.
请回答下列问题:
(1)D元素的电负性 F元素的电负性(填“>”、“<”或“=”).
(2)G的价电子排布图 .
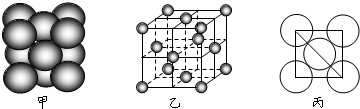
(3)B形成的晶体堆积方式为 ,空间利用率为 ;区分晶体和非晶体最可靠的科学方法是对固体进行 实验.
(4)D-的最外层共有 种不同运动状态的电子,有 种能量不同的电子.F2D2广泛用于橡胶工业,各原子均满足八电子稳定结构,F2D2中F原子的杂化类型是 ,F2D2是 分子(填“极性”或“非极性”).
(5)A与E形成的最简单化合物分子在水中溶解度很大的原因 .该分子是极性分子的原因 是 .
(6)如图所示是R形成的晶体的晶胞,设该晶体密度是ρ/g?cm-3.试计算R晶胞的体积是 (阿伏加德罗常数用NA表示,只写出计算式,不用计算)

请回答下列问题:
(1)D元素的电负性
(2)G的价电子排布图
(3)B形成的晶体堆积方式为
(4)D-的最外层共有
(5)A与E形成的最简单化合物分子在水中溶解度很大的原因
(6)如图所示是R形成的晶体的晶胞,设该晶体密度是ρ/g?cm-3.试计算R晶胞的体积是

考点:晶胞的计算,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A是宇宙中最丰富的元素,A为氢元素,D原子得一个电子填入3p轨道后,3p轨道全充满,则D为17号元素,氯元素;B和D的原子都有1个未成对电子,B+比D少一个电子层,则B为钠元素;E原子的2p轨道中有3个未成对电子,则E为氮元素;G位于周期表第6纵行且是六种元素中原子序数最大的在前四周期的,则G为铬元素;F的最高化合价和最低化合价的代数和为4,且原子序数小于铬元素,则F为硫元素;R是由B、F两元素形成的离子化合物,其中B+与F2-离子数之比为2:1;则R为Na2S,所以,A为氢,B为钠,D为氯,E为氮,F为硫,G为铬,据此答题.
解答:
解:(1)根据元素周期律可知氯的电负性大于硫,故答案为:>;
(2)铬为24号元素,价电子排布图为 ,故答案为:
,故答案为: ;
;
(3)晶体钠为体心立方堆积;空间利用率为68%;区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验,故答案为:体心立方堆积;68%;X-射线衍射;
(4)根据核外电子排布规律可知,每个电子的运动状态都不相同,氯离子最外层有8个电子,所以就有8种不同运动状态的电子,最外层有两个能级,每个能级上电子能量是相同的,所以最外层有2种能量不同的电子,在S2Cl2中要使各原子都满足8电子稳定结构,则分子存在一个硫硫键和两硫氯键,则硫原子的价电子对数为4,所以硫原子按sp3方式杂化,硫原子周围有两对孤电子对,所以分子为极性分子,
故答案为:8;2;sp3;极性;
(5)A与E形成的最简单化合物为氨气,为极性分子,水也为极性分子,根据相似相容原理,另外氨气和水分间形成氢键氢键,部分氨气和水反应化学反应,都导致氨气在水中的溶解度较大;由于在氨分子中有孤电子对的存在,分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性,所以分子显极性,
故答案为:相似相容原理氨气和水均为极性分子,氨气和水分间形成氢键氢键,部分氨气和水反应化学反应;分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性;
(6)在每个晶胞中含有钠离子数为8,硫离子数为8×
+6×
=4,根据V=
,可得晶胞的体积为
cm3=
cm3,故答案为:
cm3.
(2)铬为24号元素,价电子排布图为
 ,故答案为:
,故答案为: ;
;(3)晶体钠为体心立方堆积;空间利用率为68%;区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验,故答案为:体心立方堆积;68%;X-射线衍射;
(4)根据核外电子排布规律可知,每个电子的运动状态都不相同,氯离子最外层有8个电子,所以就有8种不同运动状态的电子,最外层有两个能级,每个能级上电子能量是相同的,所以最外层有2种能量不同的电子,在S2Cl2中要使各原子都满足8电子稳定结构,则分子存在一个硫硫键和两硫氯键,则硫原子的价电子对数为4,所以硫原子按sp3方式杂化,硫原子周围有两对孤电子对,所以分子为极性分子,
故答案为:8;2;sp3;极性;
(5)A与E形成的最简单化合物为氨气,为极性分子,水也为极性分子,根据相似相容原理,另外氨气和水分间形成氢键氢键,部分氨气和水反应化学反应,都导致氨气在水中的溶解度较大;由于在氨分子中有孤电子对的存在,分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性,所以分子显极性,
故答案为:相似相容原理氨气和水均为极性分子,氨气和水分间形成氢键氢键,部分氨气和水反应化学反应;分子中正电中心和负电中心不重合,使分子的一部分呈正电性,另一部分呈负电性;
(6)在每个晶胞中含有钠离子数为8,硫离子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| ρ |
| ||
| a |
| 4×78 |
| aNA |
| 4×78 |
| aNA |
点评:本题主要考查了原子核外电子排布、晶体的堆积方式、分子结构与性质、晶胞密度的有关计算等知识,难度中等.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
 如图所示的3种有机物中,●表示一个碳原子,氢原子未画出,则它们互为( )
如图所示的3种有机物中,●表示一个碳原子,氢原子未画出,则它们互为( )| A、同位素 | B、同系物 |
| C、同分异构体 | D、同素异形体 |