题目内容
9.5g某元素的氯化物XCl2溶于水制成溶液后,加入200ml 1mol?L_1AgNO3溶液恰好完全反应.已知该元素原子核内有12个中子.则该元素的质量数和质子数分别为 和 .
考点:质量数与质子数、中子数之间的相互关系
专题:计算题
分析:根据Cl-+Ag+═AgCl↓计算XCl的物质的量,再由M=
计算其摩尔质量,摩尔质量与相对分子质量的数值相等,结合种原子原子核内有12个中子及质量数=质子数+中子数来计算原子的质子数.
| m |
| n |
解答:
解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.2L×1mol/L=0.2mol,则n(XCl2)=0.1mol,
则M(XCl2)=
=95g/mol,
由摩尔质量与相对分子质量的数值相等及质量数=质子数+中子数,
则X=95-71=24,Z=24-12=12,
答:质量数为24,质子数为12.
则M(XCl2)=
| 9.5g |
| 0.1mol |
由摩尔质量与相对分子质量的数值相等及质量数=质子数+中子数,
则X=95-71=24,Z=24-12=12,
答:质量数为24,质子数为12.
点评:本题考查利用离子反应方程式的计算及确定元素在元素周期表中的位置、单质的性质等,较简单,难度不大,熟悉离子之间的关系、原子中的数量关系即可解答.

练习册系列答案
相关题目
可用来鉴别乙烯、四氯化碳、苯的试剂是( )
| A、酸性高锰酸钾溶液 |
| B、溴水 |
| C、液溴 |
| D、浓硝酸和浓硫酸混合液 |

 的酸性废水,可利用微生物电池法除去,其原理如图2所示
的酸性废水,可利用微生物电池法除去,其原理如图2所示
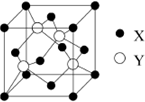 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.