题目内容
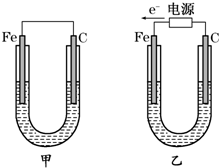
17.如图所示的四个实验中,能完成2HCl+2Ag═2AgCl+H2↑反应的实验是( )| A. | 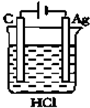 | B. | 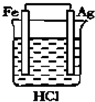 | C. | 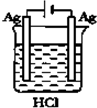 | D. | 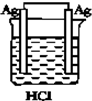 |
分析 Ag不能和HCl自发的进行氧化还原反应,所以要使反应2HCl+2Ag═2AgCl+H2↑能进行,应该设计成电解池,且Ag作阳极、电解质溶液中氢离子放电,据此分析解答.
解答 解:Ag不能和HCl自发的进行氧化还原反应,所以要使反应2HCl+2Ag═2AgCl+H2↑能进行,应该设计成电解池,Ag失电子发生氧化反应,所以Ag作阳极,氢离子得电子发生还原反应,所以电解质溶液中氢离子放电,则符合条件的是C,
故选C.
点评 本题考查原电池设计,明确原电池及电解池原理是解本题关键,根据反应是否能够自发进行确定电池类型,再根据得失电子判断电极材料和电解质,题目难度中等.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
8. 25℃时,已知:
25℃时,已知:
H2CO3?H++HCO3- K1=4.3×10-7
HCO3-?H++CO32- K2=5.6×10-11
H2O?H++OH- KW=1.0×10-14
现取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示.在25℃时,下列有关溶液中离子浓度关系叙述正确的是( )
 25℃时,已知:
25℃时,已知:H2CO3?H++HCO3- K1=4.3×10-7
HCO3-?H++CO32- K2=5.6×10-11
H2O?H++OH- KW=1.0×10-14
现取10.6g Na2CO3 与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH 的关系如图所示.在25℃时,下列有关溶液中离子浓度关系叙述正确的是( )
| A. | W 点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH=4 的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | pH=8 的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11 的溶液中:CO32-+H2O HCO3-+OH- K≈1.8×l0-4 |
5.下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
| 选项 | 微粒组 | 加人试剂 | 发生反应的离子方程式 |
| A | Fe3+、I-、Cr- | NaOH溶液 | Fe3++30H-═Fe(0H)3↓ |
| B | K+、NH3•H20、CO32- | 通人少量CO2 | 20H-+C02═CO32-+H20 |
| C | H+,Fe2+、SO42- | Ba(NO3)2溶液 | SO42-+Ba2+═BaSO4↓ |
| D | Na+、Al3+、Cl- | 少量澄淸石灰水 | Al3++30H-═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
9.已知醋酸与氢氧化钠在溶液中发生下列反应①,醋酸钠在溶液中又能跟水发生下列反应②.
①CH3COOH+Na0H=CH3COONa+H20
②CH3COONa+H20?CH3COOH+Na0H
上述化学方程式①和②可合并写为
③CH3COOH+Na0H=CH3COONa+H20
下列叙述正确的是( )
①CH3COOH+Na0H=CH3COONa+H20
②CH3COONa+H20?CH3COOH+Na0H
上述化学方程式①和②可合并写为
③CH3COOH+Na0H=CH3COONa+H20
下列叙述正确的是( )
| A. | 反应①和②都是离子反应 | B. | 反应①和②都吸收热量 | ||
| C. | 反应①和②都放出热量 | D. | 反应③既不吸收热量也不放出热量 |
6.有关离子共存的说法及相关分析正确的是( )
| A. | 含大量Al3+的溶液中:K+、Na+、NO3-、CO32-不能大量共存,因有Al2(CO3)3沉淀生成 | |
| B. | 含大量Fe3+的溶液中:K+Mg2+、I-、Br2-不能大量共存,因2Fe3++2I-=2Fe2++I2 | |
| C. | 由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、NO3-、HCO3-、Cl-不能大量共存,因溶液呈酸性,与HCO3-反应产生CO2气体 | |
| D. | 在NH4Fe(SO4)2溶液中:Na+、K+、S2-、SCN-不能大量共存,只是因Fe3+和S2-反应产生淡黄色的S沉淀 |
19.下列有关说法或表示正确的是( )
| A. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| B. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O | |
| C. | Fe-2e-=Fe2+可表示钢铁析氢腐蚀和吸氧腐蚀的正极反应 | |
| D. | 乙醇分子的比例模型: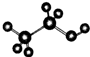 |
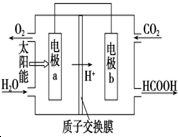 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.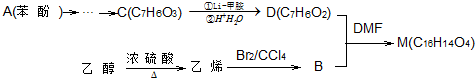
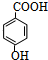

 .
.