题目内容
氮族元素最外层电子数为
5
5
,随着核电荷数的递增,氮族元素的原子半径逐渐增大
增大
、得电子能力逐渐减弱
减弱
、非金属性逐渐减弱
减弱
、其气态氢化物的稳定性逐渐减弱
减弱
.分析:氮族元素处于Ⅴ族,最外层电子数为5;同主族自上而下原子半径增大,原子核对核外电子的吸引减弱,得电子能力减弱、非金属性减弱,非金属性越强氢化物越稳定.
解答:解:氮族元素处于Ⅴ族,最外层电子数为5;同主族自上而下电子层增多,原子半径增大,原子核对核外电子的吸引减弱,得电子能力减弱、非金属性减弱,气态氢化物的稳定性逐渐减弱,
故答案为:5;增大、减弱、减弱、减弱.
故答案为:5;增大、减弱、减弱、减弱.
点评:本题考查同主族元素性质的递变规律,比较基础,注意根据结构理解掌握同主族、同周期元素性质递变.

练习册系列答案
相关题目



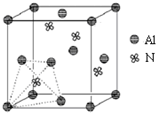 元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:




