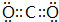题目内容
已知短周期A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子;E与C同族.请回答下列问题:
(1)E元素最外层电子的轨道表示式为
 .
.
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物,其电子式为
 ,它的晶体中含有多种化学键,但 一定不含有的化学键是
,它的晶体中含有多种化学键,但 一定不含有的化学键是
A.极性键 B.非极性键C.配位键 D.金属键.
(1)E元素最外层电子的轨道表示式为


(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
C<O<N
C<O<N
(填元素符号),其原因是氮的最外层2s22p3为半满结构,较稳定
氮的最外层2s22p3为半满结构,较稳定
.(3)D元素与氟元素相比,电负性:D
<
<
F(填“>”、“=”或“<”),下列表述中能证明这一事实的是BC
BC
(填选项序号)A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物,其电子式为


BD
BD
(填选项序号).A.极性键 B.非极性键C.配位键 D.金属键.
分析:A原子所处的周期数、族序数都与其原子序数相等,应为H元素,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,说明有6个电子,应为C元素;D原子L层上有2对成对电子,应为O元素;E与C同族,五种元素的原子序数依次增大,可知C为N元素,E为P元素,结合对应单质、化合物的性质以及题目要求解答该题.
解答:解:A原子所处的周期数、族序数都与其原子序数相等,应为H元素,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,说明有6个电子,应为C元素;D原子L层上有2对成对电子,应为O元素;E与C同族,五种元素的原子序数依次增大,可知C为N元素,E为P元素,
(1)E为P元素,最外层电子的轨道表示式为 ,故答案为:
,故答案为: ;
;
(2)B、C、D三种元素分别是C、N、O元素,N的最外层为包充满结构,第一电离能最大,C的最小,则第一电离能数值由小到大的顺序为C<O<N,
故答案为:C<O<N;氮的最外层2s22p3为半满结构,较稳定;
(3)D为O元素,电负性小于F,可根据与氢气反应的剧烈程度判断,不能根据物质的颜色或得失电子的数目比较,在氟与D形成的化合物中D元素呈正价态,也可说明F得电子能力较强,电负性较大,故答案为:<;BC;
(4)只含N、H两元素的离子化合物,其电子式为 ,含有极性键和配位键,故答案为:
,含有极性键和配位键,故答案为: ;BD.
;BD.
(1)E为P元素,最外层电子的轨道表示式为
 ,故答案为:
,故答案为: ;
;(2)B、C、D三种元素分别是C、N、O元素,N的最外层为包充满结构,第一电离能最大,C的最小,则第一电离能数值由小到大的顺序为C<O<N,
故答案为:C<O<N;氮的最外层2s22p3为半满结构,较稳定;
(3)D为O元素,电负性小于F,可根据与氢气反应的剧烈程度判断,不能根据物质的颜色或得失电子的数目比较,在氟与D形成的化合物中D元素呈正价态,也可说明F得电子能力较强,电负性较大,故答案为:<;BC;
(4)只含N、H两元素的离子化合物,其电子式为
 ,含有极性键和配位键,故答案为:
,含有极性键和配位键,故答案为: ;BD.
;BD.点评:本题综合考查元素位置、结构与性质的关系,综合考查学生的分析能力、推断能力和综合运用化学知识的能力,难度较大,注意把握电子式的书写.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同. 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同.回答下列问题: (2013?浙江模拟)三种短周期A、B、C在元素周期表中的位置如图所示.已知A、B、C 三种元素的原子最外层电子数之和为15.据此填空:
(2013?浙江模拟)三种短周期A、B、C在元素周期表中的位置如图所示.已知A、B、C 三种元素的原子最外层电子数之和为15.据此填空: