题目内容
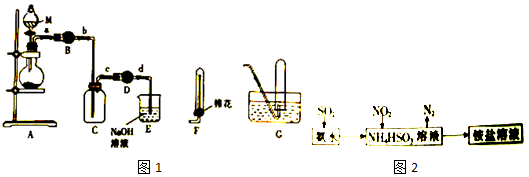
11. 如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.
如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.(1)反应条件的选择是工业生产的关键步骤.写出①、③、④三步的反应条件:①高温加热(或高温)、③蒸发结晶、④电解.
(2)反应②需要加入的试剂是水.
(3)写出反应⑤生成漂白粉的化学方程式:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
(4)工业生产要注重效益、要关注节能减排,保护环境.请你从这个思路出发,列举上述工艺中的特点:利用废弃物贝壳、利用电解产生的氢气燃烧给贝壳加热、生产副产物NaOH等(列出两个即可).
分析 贝壳煅烧得到A为氧化钙和二氧化碳,氧化钙溶于水生成B为氢氧化钙,海水蒸发结晶得到C为氯化钠,电解饱和氯化钠溶液得到D为氯气,E为氢气,氯气和氢氧化钙反应生成漂白粉,E为氢气燃烧提供热量分解碳酸钙,
(1)①、③、④三步分别为煅烧碳酸钙、蒸发结晶、第饱和食盐水;
(2)步骤②是生石灰溶于水反应生成氢氧化钙的反应;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(4)利用废弃物贝壳、利用电解产生的氢气燃烧给贝壳加热,生产氢氧化钠;
解答 解;贝壳煅烧得到A为氧化钙和二氧化碳,氧化钙溶于水生成B为氢氧化钙,海水蒸发结晶得到C为氯化钠,电解饱和氯化钠溶液得到D为氯气,E为氢气,氯气和氢氧化钙反应生成漂白粉,E为氢气燃烧提供热量分解碳酸钙,
(1)①、③、④三步分别为煅烧碳酸钙、蒸发结晶、第饱和食盐水,需要的条件是:高温加热(或高温)、蒸发结晶、电解,
故答案为:高温加热(或高温) 蒸发结晶 电解;
(2)步骤②是生石灰溶于水反应生成氢氧化钙的反应,反应②需要加入的试剂是水,
故答案为:水;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(4)上述工艺中的特点是利用废弃物贝壳、利用电解产生的氢气燃烧给贝壳加热,生产氢氧化钠;
故答案为:利用废弃物贝壳、利用电解产生的氢气燃烧给贝壳加热、生产副产物NaOH等;
点评 本题考查了海水资源的利用和物质制备、反应条件、反应产物,掌握基础是解题关键,题目难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
2.明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”下列说法不正确的是(注:炉甘石的主要成分为碳酸锌)( )
| A. | 该冶炼锌的反应属于置换反应 | |
| B. | 煤炭中起作用的主要成分是C(碳) | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C $\frac{\underline{\;高温\;}}{\;}$ Zn+3CO↑ | |
| D. | 倭铅是指金属锌和铅的混合物 |
6.在一次重大车祸事故中,有一人双腿骨折,医生将他受伤较重的膝关节用人造骨骼代替,下列可用作人造关节且利用的性质正确的是( )
| A. | 氮化硅陶瓷 耐高温 | B. | 氧化锆陶瓷 韧性和耐磨性 | ||
| C. | 钛酸钡陶瓷 导电性 | D. | 氧化铝陶瓷 透光性 |
20.已知草酸为二元中强酸,具有较强还原性,草酸氢钠(NaHC2O4)水溶液呈酸性,下列说法正确的是( )
| A. | 草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+c(C2O42-) | |
| B. | NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- | |
| C. | 草酸铵溶液中:c(NH4+)=2 c(H2C2O4)+2 c(HC2O4-)+2 c(C2O42-) | |
| D. | 草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
1.在下述条件下,一定能大量共存的离子组是( )
| A. | 无色透明的水溶液中:K+、Ba2+、Cu2+、I- | |
| B. | 含有大量H+的水溶液中:NH4+、Fe2+、SO42-、MnO4- | |
| C. | c(HCO3-)=0.1mol/L的溶液中:Na+、K+、CO32-、Br- | |
| D. | 强碱性溶液中:Cl-、SO32-、HSO3-、Na+ |
 如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之
如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之  最难.
最难.