题目内容
20.已知草酸为二元中强酸,具有较强还原性,草酸氢钠(NaHC2O4)水溶液呈酸性,下列说法正确的是( )| A. | 草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+c(C2O42-) | |
| B. | NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- | |
| C. | 草酸铵溶液中:c(NH4+)=2 c(H2C2O4)+2 c(HC2O4-)+2 c(C2O42-) | |
| D. | 草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
分析 草酸氢钠(NaHC204)水溶液呈酸性,说明草酸氢根离子电离程度大于其水解程度,草酸为二元中强酸,具有较强还原性,能被强氧化性物质氧化,结合电荷守恒、物料守恒来分析解答,
A、混合溶液呈中性,则c(H+)=c(HO-),根据电荷守恒得c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42- )+c(HO-);
B、草酸氢钠(NaHC204)水溶液呈酸性,草酸氢根离子具有较强还原性,能被强氧化性物质氧化;
C、结合物料守恒来分析,n(Na)=n(C)守恒列式分析判断;
D、草酸具有还原性,酸性高锰酸钾具有强氧化性,所以醋酸能被酸性高锰酸钾氧化生成二氧化碳.
解答 解:A.混合溶液呈中性,则c(H+)=c(HO-),根据电荷守恒得c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42- )+c(HO-),所以得c(Na+)=c(HC2O4-)+2c(C2O42- ),故A错误;
B.草酸具有还原性,能被次氯酸钠氧化生成二氧化碳,故B错误;
C.根据物料守恒得c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42- ),故C错误;
D.草酸具有还原性,酸性高锰酸钾具有强氧化性,所以醋酸能被酸性高锰酸钾氧化生成二氧化碳,其离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,故D正确;
故选D.
点评 本题考查了氧化还原反应、离子浓度大小的判断,明确草酸的性质是解本题关键,结合物料守恒和电荷守恒来分析解答,易错选项是B,很多同学只考虑酸性强弱而漏掉次氯酸根离子的强氧化性而导致错误,为易错点,题目难度中等.

练习册系列答案
相关题目
10.向某溶液里加入过量的氨水或过量的氢氧化钠溶液,均有沉淀产生;若加入铁粉或铜粉,溶液的质量都增加,则该溶液里一定含有下列离子中的( )
| A. | Al3+ | B. | Fe2+ | C. | Fe3+ | D. | Cu2+ |
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol羟基( )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| B. | 1 L 0.1 mol•L-1的AlCl3 溶液中含有Al3+的数目为0.1 NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA |
9.下列离子方程式不正确的是( )
| A. | 用Cu作阳极电解饱和食盐水:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑ | |
| B. | Fe3O4溶于氢碘酸溶液中:Fe3O4+8H++2I-=3Fe2++I2+4H2O | |
| C. | NH4Al(SO4)2溶于过量的浓Ba(OH)2溶液中:NH4++A13++2SO42-+2Ba2++5OH-=2BaSO4↓+AlO2-+NH3↑+H2O | |
| D. | 澄清石灰水中充入过量的SO2:SO2+OH-=HSO3- |
10. 如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
 如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )| A. | a极为负极,发生还原反应 | |
| B. | b电极上电极反应:O2+2H2O+4e-=4OH- | |
| C. | 工作时电子由b极经外电路流向a极 | |
| D. | 该装置实现了电能转化成化学能 |
 如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题.
如图的框图是利用海水和海边贝壳为原料设计的制备漂白粉的工艺流程.分析图示各物质的关系,然后回答问题. “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:
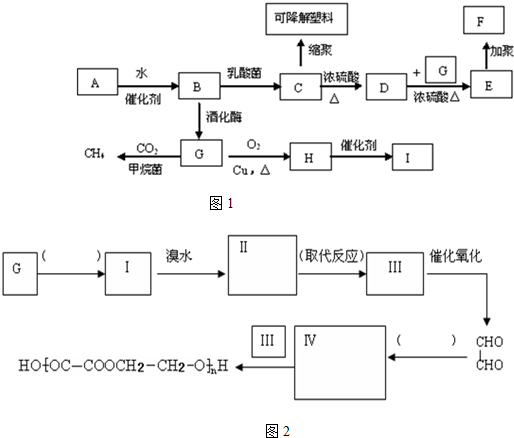
 六元环状化合物I
六元环状化合物I
 .
. 的合成路线如图2:(按要求填写,消去反应;氧化反应内填写反应类型,内填写Ⅱ和Ⅳ的结构简式)
的合成路线如图2:(按要求填写,消去反应;氧化反应内填写反应类型,内填写Ⅱ和Ⅳ的结构简式)