题目内容
1.在一定温度下,向15g蒸馏水中加入无水硫酸铜粉末,充分搅拌并过滤,得到一定质量的蓝色五水合硫酸铜晶体和8.4g滤液,若此温度下无水硫酸铜的溶解度为40g,则加入的无水硫酸铜的质量是18.4g.分析 以15g水为线索,先计算8.4g饱和硫酸铜溶液中含有硫酸铜、水的质量,然后根据剩余的水存在于蓝色五水合硫酸铜晶体,计算形成晶体所需硫酸铜的质量.
解答 解:8.4g饱和硫酸铜溶液中含有硫酸铜的质量为8.4g×$\frac{40g}{100+40g}$×100%=2.4g,溶剂水的质量为8.4g-2.4g=6.0g,
则15g-6g=9g水与硫酸铜结合形成五水合硫酸铜晶体,该晶体中含有硫酸铜的质量为9g×$\frac{160}{5×18}$=16g,
因此加入的无水硫酸铜的质量是2.4g+16g=18.4g,
故答案为:18.4g.
点评 本题考查了溶液中溶质的质量分数及其相关计算,难度中等,明确滤液为饱和溶液及理清水的去向是解题的关键.

练习册系列答案
相关题目
16.下列有关试剂的保存方法,错误的是( )
| A. | 苯酚晶体隔绝空气密封保存 | |
| B. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| C. | 少量的钠保存在乙醇中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
9.水溶液是中学化学的重点研究对象.
(1)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.①浓度为1.0×10-3 mol•L-1的氨水b L;②c(OH-)=1.0×10-3 mol•L-1的氨水c L;③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间的关系是b>a=d>c.
(2)已知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则①c(Ag+)=1.8×10-7mol/L,②此时所得混合溶液的pH=2.
(3)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
①上述盐溶液中的阴离子,结合质子能力最强的是CO32-.
②根据表中数据,浓度均为0.01mol•L-1的下列五种物质的溶液中,分别稀释100倍,pH变化最小的是C(填编号).
A、HCN B、HClO C、HX D、CH3COOH E、H2CO3
③据上表数据,请你判断下列反应不能成立的是BD(填编号).
A.2CH3COOH+Na2CO3═CO2+H2O+2CH3COONa
B.HClO+HCO3-═ClO-+CO2+H2O
C.CH3COOH+NaCN═CH3COONa+HCN
D.CO2+H2O+2NaX═Na2CO3+2HX
(4)将NaHCO3溶液与FeCl3溶液混合,反应的离子方程式是:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑.
(1)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.①浓度为1.0×10-3 mol•L-1的氨水b L;②c(OH-)=1.0×10-3 mol•L-1的氨水c L;③c(OH-)=1.0×10-3 mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间的关系是b>a=d>c.
(2)已知:Ksp(AgCl)=1.8×10-10,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则①c(Ag+)=1.8×10-7mol/L,②此时所得混合溶液的pH=2.
(3)常温下,浓度均为0.1mol•L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaX |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据,浓度均为0.01mol•L-1的下列五种物质的溶液中,分别稀释100倍,pH变化最小的是C(填编号).
A、HCN B、HClO C、HX D、CH3COOH E、H2CO3
③据上表数据,请你判断下列反应不能成立的是BD(填编号).
A.2CH3COOH+Na2CO3═CO2+H2O+2CH3COONa
B.HClO+HCO3-═ClO-+CO2+H2O
C.CH3COOH+NaCN═CH3COONa+HCN
D.CO2+H2O+2NaX═Na2CO3+2HX
(4)将NaHCO3溶液与FeCl3溶液混合,反应的离子方程式是:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑.
6.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3、浓H2SO4反应生成SeO2以回收Se.在回收过程当中涉及到如下两个化学反应
①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
下列有关叙述正确的是( )
①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
下列有关叙述正确的是( )
| A. | SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 | |
| B. | ①中Se是氧化产物,I2是还原产物 | |
| C. | 反应①中KI是氧化剂,SeO2是还原剂 | |
| D. | 反应①中每有1.0mol I2生成,转移电子数目为4NA |
13.甲、乙两种物质的溶解曲线如图所示.下列说法正确的是( )
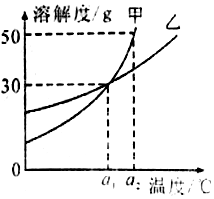

| A. | a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 | |
| B. | 甲和乙的溶解度相等 | |
| C. | a1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液 | |
| D. | a2℃时,在100g水中加入60g甲,形成不饱和溶液 |
10.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 22.4 L乙烷分子中的碳原子数目为2NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 NA | |
| C. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
11.在温度相同时,100mL0.01mol/L的CH3OOH溶液与10mL0.1mol/LCH3COOH溶液相比较,下列叙述中前者大于后者的是( )
| A. | CH3OOH的物质的量 | |
| B. | 溶液中的n(H+) | |
| C. | 用同浓度的NaOH溶液恰好完全反砬,消耗NaOH溶液的体积 | |
| D. | 溶液的导电能力 |