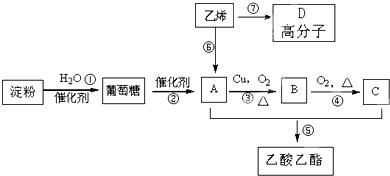
题目内容
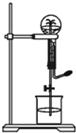 喷泉是一种常见的自然现象,其产生原因是存在压强差.图中为化学教学中所用的喷泉实验装置实验装置.已知3NO2+H2O=2HNO3+NO (NO为气体,难溶于水)在烧瓶中充满干燥NO2气体,胶头滴管及烧杯中分别盛有水进行喷泉实验.假设实验在标准状况下进行,经充分反应后,计算瓶内HNO3溶液的物质的量浓度为多少?
喷泉是一种常见的自然现象,其产生原因是存在压强差.图中为化学教学中所用的喷泉实验装置实验装置.已知3NO2+H2O=2HNO3+NO (NO为气体,难溶于水)在烧瓶中充满干燥NO2气体,胶头滴管及烧杯中分别盛有水进行喷泉实验.假设实验在标准状况下进行,经充分反应后,计算瓶内HNO3溶液的物质的量浓度为多少?考点:物质的量浓度的相关计算
专题:
分析:设烧瓶的容积为22.4L,则标况下22.4L氮气的物质的量为1mol,根据反应方程式3NO2+H2O=2HNO3+NO可知,反应后生成硝酸的物质的量为
mol,生成一氧化氮的物质的量为
mol,根据标况下的气体摩尔体积计算出一氧化氮体积,从而计算出反应后烧瓶中溶液体积,然后根据c=
计算出溶液的物质的量浓度.
| 2 |
| 3 |
| 1 |
| 3 |
| n |
| V |
解答:
解:二氧化氮与水反应方程式为:3NO2+H2O=2HNO3+NO,
设烧瓶体积为22.4L,则标准状况下二氧化氮的物质的量为:
=1mol,
1mol二氧化氮完全反应生成
mol硝酸、
molNO,
反应后烧瓶中溶液体积为:22.4L-22.4L/mol×
mol=
L,
反应后的溶液的物质的量浓度为:c=
=
mol/L,
答:瓶内HNO3溶液的物质的量浓度为
mol/L.
设烧瓶体积为22.4L,则标准状况下二氧化氮的物质的量为:
| 22.4L |
| 22.4L/mol |
1mol二氧化氮完全反应生成
| 2 |
| 3 |
| 1 |
| 3 |
反应后烧瓶中溶液体积为:22.4L-22.4L/mol×
| 1 |
| 3 |
| 44.8 |
| 3 |
反应后的溶液的物质的量浓度为:c=
| ||
|
| 1 |
| 22.4 |
答:瓶内HNO3溶液的物质的量浓度为
| 1 |
| 22.4 |
点评:本题考查了物质的量浓度的计算,题目难度中等,明确反应后溶质、溶液体积为解答关键,注意掌握物质的量浓度的概念及表达式,试题充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
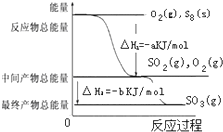 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1 mol含硫产物的数据).由图得出的结论正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1 mol含硫产物的数据).由图得出的结论正确的是( )| A、S8(s)的燃烧热△H=-8akJ?mol-1 |
| B、2SO3(g)?2SO2(g)+O2(g);△H=-2b kJ?mol-1 |
| C、S8(s)+8O2(g)=8SO2(g);△H=-a kJ?mol-1 |
| D、由1molS8(s)生成SO3(g)的反应热△H=-(a+b)kJ?mol-1 |
已知在101kPa、25℃条件下,2mol氢气完全燃烧生成水蒸气放出484kJ的热量,下列热化学方程式正确的是( )
A、H2O(g)=H2 (g)+
| ||
| B、2H2 (g)+O2(g)=2H2O(l)△H=-484 kJ∕mol | ||
C、H2 (g)+
| ||
| D、2H2 (g)+O2(g)=2H2O(g)△H=+484 kJ∕mol |
100mL0.3mol?L-1Na2SO4溶液和50mL0.2mol?L-1Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度(设体积为二者之和)为( )
| A、0.2mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.5 mol?L-1 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1molCl2参加的任何反应转移电子数都是2NA |
| B、1mol/L的NaCl溶液中含有NA个Na+ |
| C、标准状况下,22.4ml水中含有的分子数约为1.24NA |
| D、1molFeCl3完全水解生成NA个胶体粒子 |
NA为阿伏加德罗常数,下列物质所含分子数最少的是( )
| A、含NA个分子的二氧化硫 |
| B、0.5 mol氧气 |
| C、标准状况下5.6 L氢气 |
| D、9 g水 |
溶液、胶体、浊液这三种分散系的本质区别是( )
| A、分散质粒子大小不同 |
| B、稳定性不同 |
| C、是否具有丁达尔效应 |
| D、能否透过滤纸 |