题目内容
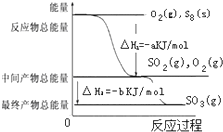 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1 mol含硫产物的数据).由图得出的结论正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1 mol含硫产物的数据).由图得出的结论正确的是( )| A、S8(s)的燃烧热△H=-8akJ?mol-1 |
| B、2SO3(g)?2SO2(g)+O2(g);△H=-2b kJ?mol-1 |
| C、S8(s)+8O2(g)=8SO2(g);△H=-a kJ?mol-1 |
| D、由1molS8(s)生成SO3(g)的反应热△H=-(a+b)kJ?mol-1 |
考点:反应热和焓变
专题:
分析:A.依据燃烧热概念分析计算;
B.1molSO3分解吸收b kJ热量;
C.1molO2和
molS8反应生成二氧化硫放热aKJ;
D.1molS8(s)生成SO3(g)放出8(a+b)KJ热量.
B.1molSO3分解吸收b kJ热量;
C.1molO2和
| 1 |
| 8 |
D.1molS8(s)生成SO3(g)放出8(a+b)KJ热量.
解答:
解:A.依据图象分析1molO2和
molS8反应生成二氧化硫放热aKJ/mol,依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式为:S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol,则S8(s)的燃烧热△H=-8akJ?mol-1,故A正确;
B.1molO2和
molS8反应生成二氧化硫放热aKJ,则2SO3(g)?2SO2(g)+O2(g);△H=+2b kJ?mol-1,故B错误;
C.1molO2和
molS8反应生成二氧化硫放热aKJ,则S8(s)+8O2(g)=8SO2(g);△H=-8a kJ?mol-1;故C错误;
D.1molS8(s)生成SO3(g)放出8(a+b)KJ热量,则由1molS8(s)生成SO3(g)的反应热△H=-8(a+b)kJ?mol-1,故D错误;
故选A.
| 1 |
| 8 |
B.1molO2和
| 1 |
| 8 |
C.1molO2和
| 1 |
| 8 |
D.1molS8(s)生成SO3(g)放出8(a+b)KJ热量,则由1molS8(s)生成SO3(g)的反应热△H=-8(a+b)kJ?mol-1,故D错误;
故选A.
点评:本题考查了反应能量变化的分析判断,焓变的计算应用,反应热和键能的计算关系应用,图象分析和概念理解是解题关键,题目难度中等.

练习册系列答案
相关题目
下列物质不属于电解质的是( )
| A、Cu |
| B、KOH |
| C、H2SO4 |
| D、Na2CO3 |
下列提纯物质的方法正确的是( )
| A、用酒精萃取碘水中的碘 |
| B、用分液的方法除去NaCl溶液中含有的少量氢氧化铁胶体 |
| C、用溶解、过滤、蒸发的方法提纯含有少量CaCO3的KCl |
| D、用加硫酸钠溶液再过滤的方法提纯含少量硝酸钡的硝酸钾溶液 |
已知某温度下CH3COOH和NH3?H2O的电离常数相等,现向1mL浓度为0.5mol?L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
| A、水的电离程度始终增大 | ||||
| B、当加入氨水的体积为1 mL时,c(NH4+)=c(CH3COO-) | ||||
C、
| ||||
| D、c(CH3COOH)与c(CH3COO-)之和始终保持不变 |
下列说法中正确的是( )
| A、氢氧燃料电池在熔融氧化物电解质中的正极反应式为:O2+4e-=2O2- |
| B、用铜电极电解饱和食盐水时,阳极的电极反应式为:2C1--2e-=C12↑ |
| C、铁制品镀锌时,要用锌作阴极,电极反应式为:Zn-2e-=Zn2+ |
| D、银在水膜酸性较强的溶液中将会发生析氢腐蚀,正极反应式为:2H++2e-=H2↑ |
关于下列图示的说法中正确的是( )
A、 表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”中的△H>0 |
B、 为电解硫酸铜溶液的装置,电解前后溶液的pH几乎不变 |
C、 实验装置可完成比较乙酸、碳酸、硅酸酸性强弱的实验 |
D、 两个装置通过的电量相等时,消耗负极材料的物质的量也相同 |
美国某技术公司开发出纳米级催化剂,可在较低温度下将甲烷转化成乙烯:2CH4(g)?C2H4(g)+2H2(g)△H,已知在降低温度时该反应平衡向左移动,且有下列两个反应(Q1、Q2均为正值):
反应Ⅰ:C(s)+2H2(g)═CH4(g)△H1=-Q1 反应Ⅱ:C(s)+H2(g)═
C2H4(g)△H2=-Q2
则下列判断正确的是( )
反应Ⅰ:C(s)+2H2(g)═CH4(g)△H1=-Q1 反应Ⅱ:C(s)+H2(g)═
| 1 |
| 2 |
则下列判断正确的是( )
| A、△H<0 |
| B、Q2>Q1 |
| C、△H=2(Q1-Q2) |
| D、△H=Q1-Q2 |
下列有关反应的反应类型叙述正确的是( )
| A、HClO+NaOH=NaClO+H2O 非氧化还原反应 复分解反应 |
| B、MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O氧化还原反应 分解反应 |
| C、3Fe+2O2=Fe3O4 非氧化还原反应 化合反应 |
| D、Fe2O3+3CO=2Fe+3CO2 氧化还原反应 置换反应 |
 喷泉是一种常见的自然现象,其产生原因是存在压强差.图中为化学教学中所用的喷泉实验装置实验装置.已知3NO2+H2O=2HNO3+NO (NO为气体,难溶于水)在烧瓶中充满干燥NO2气体,胶头滴管及烧杯中分别盛有水进行喷泉实验.假设实验在标准状况下进行,经充分反应后,计算瓶内HNO3溶液的物质的量浓度为多少?
喷泉是一种常见的自然现象,其产生原因是存在压强差.图中为化学教学中所用的喷泉实验装置实验装置.已知3NO2+H2O=2HNO3+NO (NO为气体,难溶于水)在烧瓶中充满干燥NO2气体,胶头滴管及烧杯中分别盛有水进行喷泉实验.假设实验在标准状况下进行,经充分反应后,计算瓶内HNO3溶液的物质的量浓度为多少?