题目内容
100mL0.3mol?L-1Na2SO4溶液和50mL0.2mol?L-1Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度(设体积为二者之和)为( )
| A、0.2mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.5 mol?L-1 |
考点:物质的量浓度的相关计算
专题:
分析:根据n=cV计算各溶液中溶质的物质的量,进而计算各自含有SO42-离子物质的量,两溶质含有的SO42-的物质的量之和为混合溶液中SO42-离子的物质的量,根据公式c=
来计算SO42-离子的物质的量浓度.
| n |
| V |
解答:
解:Na2SO4的物质的量为 0.1mL×0.3mol/L=0.03 mol,则n(SO42-)=为0.03 mol,
Al2(SO4)3 的物质的量为:0.05mL×0.2mol/L=0.01 mol,则n(SO42-)=3×0.01mol=0.03 mol,所以混合后溶液中(SO42-)=0.03mol+0.03mol=0.06mol,混合后溶液的体积可以粗略认为是两溶液混合后体积之和,故硫酸根的物质的量浓度=
=0.40mol/L,
故选C.
Al2(SO4)3 的物质的量为:0.05mL×0.2mol/L=0.01 mol,则n(SO42-)=3×0.01mol=0.03 mol,所以混合后溶液中(SO42-)=0.03mol+0.03mol=0.06mol,混合后溶液的体积可以粗略认为是两溶液混合后体积之和,故硫酸根的物质的量浓度=
| 0.06mol |
| 0.15L |
故选C.
点评:本题考查物质的量浓度的计算,是一道基础知识题目,注意根据公式来计算.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、氢氧燃料电池在熔融氧化物电解质中的正极反应式为:O2+4e-=2O2- |
| B、用铜电极电解饱和食盐水时,阳极的电极反应式为:2C1--2e-=C12↑ |
| C、铁制品镀锌时,要用锌作阴极,电极反应式为:Zn-2e-=Zn2+ |
| D、银在水膜酸性较强的溶液中将会发生析氢腐蚀,正极反应式为:2H++2e-=H2↑ |
下列各组物质中,每种物质都既能被氧化又能被还原的是( )
| A、SO2、HCl |
| B、HNO3、H2SO4 |
| C、Na2S、NH4HCO3 |
| D、SO3、Cl2 |
实验室制备氯气的反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,有关该反应的说法正确的是( )
| ||
| A、HCl是氧化剂 |
| B、Cl元素被还原 |
| C、MnO2在反应中失去电子 |
| D、生成1 mol Cl2时有2 mol电子转移 |
下列叙述中正确的有( )
①NH4I的电子式:
②8个中子的碳原子的核素符号:
C
③碘酒、淀粉、水雾、纳米材料均为胶体
④烧碱、冰醋酸、氯仿、胆矾均为电解质
⑤用托盘天平称取8.75g食盐
⑥用酸式滴定管量取23.22mL高锰酸钾溶液
⑦C60、C70、金刚石、石墨均为碳的同素异形体
⑧X射线、质谱、核磁共振属于现代化学对物质结构进行研究的手段.
①NH4I的电子式:

②8个中子的碳原子的核素符号:
14 6 |
③碘酒、淀粉、水雾、纳米材料均为胶体
④烧碱、冰醋酸、氯仿、胆矾均为电解质
⑤用托盘天平称取8.75g食盐
⑥用酸式滴定管量取23.22mL高锰酸钾溶液
⑦C60、C70、金刚石、石墨均为碳的同素异形体
⑧X射线、质谱、核磁共振属于现代化学对物质结构进行研究的手段.
| A、②③④⑥⑦⑧ | B、①③④⑥⑦ |
| C、②⑥⑦⑧ | D、②⑦⑧ |
用NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
| A、常温下,1mol CO2含有的氧原子数为2NA |
| B、0.1mol/L的Al2(SO4)3溶液中含SO42-数为0.3NA |
| C、标况下9g水所含分子数为0.5NA |
| D、常温下,2g氦气所含有原子数为0.5NA |
下列离子方程式书写不正确的是( )
| A、石灰乳跟稀硝酸反应:Ca(OH)2+2H+═Ca2++2H2O |
| B、铜粉投入到硝酸银溶液中:Cu+Ag+═Cu2++Ag |
| C、AlCl3溶液中加入少量的氢氧化钠:Al3++3OH-═Al(OH)3↓ |
| D、钠和冷水反应 2Na+2H2O═2Na++2OH-+H2↑ |
已知:2Fe2++Br2=2Fe3++2Br-,若向100mL FeBr2溶液中缓慢通入2.24L标况下的氯气,充分反应后,有
的Br-被氧化成Br2,则原FeBr2溶液的物质的量浓度为( )
| 1 |
| 5 |
| A、1.4mol/L |
| B、2.5mol/L |
| C、无法计算 |
| D、5.0mol/L |
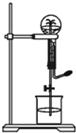 喷泉是一种常见的自然现象,其产生原因是存在压强差.图中为化学教学中所用的喷泉实验装置实验装置.已知3NO2+H2O=2HNO3+NO (NO为气体,难溶于水)在烧瓶中充满干燥NO2气体,胶头滴管及烧杯中分别盛有水进行喷泉实验.假设实验在标准状况下进行,经充分反应后,计算瓶内HNO3溶液的物质的量浓度为多少?
喷泉是一种常见的自然现象,其产生原因是存在压强差.图中为化学教学中所用的喷泉实验装置实验装置.已知3NO2+H2O=2HNO3+NO (NO为气体,难溶于水)在烧瓶中充满干燥NO2气体,胶头滴管及烧杯中分别盛有水进行喷泉实验.假设实验在标准状况下进行,经充分反应后,计算瓶内HNO3溶液的物质的量浓度为多少?