题目内容
17.能正确表示下列反应的离子方程式是( )| A. | 纯碱溶液中逐滴加少量盐酸:CO32-+H+═HCO3- | |
| B. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | |
| C. | 向FeBr2溶液中通入过量Cl2的离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 过氧化氢能使酸性KMnO4溶液褪色:3H2O2+2MnO4-+6H+═2Mn2++4O2↑+6H2O |
分析 A.与少量盐酸反应生成碳酸氢钠;
B.失去电子生成亚铁离子;
C.通入过量Cl2,亚铁离子、溴离子均全部被氧化;
D.电子不守恒.
解答 解:A.纯碱溶液中逐滴加少量盐酸的离子反应为CO32-+H+═HCO3-,故A正确;
B.钢铁发生吸氧腐蚀时,铁作负极被氧化,负极反应为Fe-2e-=Fe2+,故B错误;
C.向FeBr2溶液中通入过量Cl2的离子方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C错误;
D.过氧化氢能使酸性KMnO4溶液褪色的离子反应为5H2O2+2MnO4-+6H+═2Mn2++5O2↑+8H2O,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意与量有关的反应及电子守恒判断,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
8.双级膜电渗析解离NaCl溶液制备酸碱的原理,为提高海水淡化的附加值提供了新的技术路径.已知BP为双级膜,阴阳膜界面可以解离H+和OH-,下列说法正确的是( )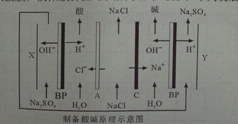

| A. | A为阳离子交换膜,C为阴离子交换膜 | |
| B. | X为阴极,发生的电极反应方程式为:4OH--4e-=O2↑+2H2O | |
| C. | 在X、Y极室加入Na2SO4,目的是提供制备的酸和碱的阳离子或阴离子 | |
| D. | 通过该装置,不但海水得到了淡化,同时还可以得到NaOH、HCl、H2、O2等物质 |
12.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,反应物总能量<生成物总能量 | |
| B. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 相同条件下,1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,含1 mol NaOH的NaOH溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量 |
2.某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳.由此可以得出该有机物的组成必须满足
( )
( )
| A. | 分子中C、H、O的个数比为1:2:3 | B. | 分子中C、H的个数比为1:2 | ||
| C. | 该有机物的分子量为14 | D. | 该分子中肯定不含氧元素 |
6.已知有机物A跟NaOH稀溶液共热后,生成B和C;B的固体与碱石灰共热生成气体D(天然气主要成分);C在加热并有催化剂存在的条件下被空气氧化成E;E跟新制的Cu(OH) 2在加热时生成F,F与NaOH溶液作用生成B,则A是( )
| A. | HCOOC 2H 5 | B. | CH 3COOCH 2CH 2CH 3 | ||
| C. | CH 3CH 2Cl | D. | CH 3COOC 2H 5 |
4.一种新型锂-氧电池,其能量密度极高.电池中添加碘化锂(LiI)和微量水,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2
I2+4LiOH,对于该电池的说法不正确的是( )
I2+4LiOH,对于该电池的说法不正确的是( )
| A. | 放电时负极上I-被氧化 | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 充电时阴极反应为:LiOH+e-═Li+OH- | |
| D. | 放电时正极反应为:O2+2H2O+4Li++4e-═4LiOH |
 C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5 min后达平衡。已知该反应在此温度下平衡常数K=1,若温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
 ;
;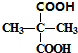 +2C2H5OH$→_{△}^{浓硫酸}$
+2C2H5OH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为 .
. 、
、 .
.