题目内容
明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重 要原料,其步骤如图,回答下列问题:
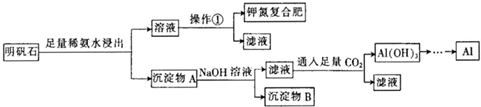
(1)明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为
(2)沉淀物A中除含有Fe2Q3外,还含有 、 .
(3)操作①的名称为 、冷却结晶、过滤.
(4)用14mol.L-1的浓氨水配制480mL 2mol.L?1稀氨水:
①所用的容量瓶规格是 .
②稀释浓氨水用的烧杯和玻璃棒如何洗涤?
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水: .
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2?3次,并将洗涤液转人容量瓶中:.
(5)确定钾氮复合肥中含有钾元素的方法是.
(6)为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生 的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL.则钾氮复合肥中氮元索的质量分数为 (用含m、V的代数式表示).

(1)明矾石加人足量的稀氨水中浸出时发生反应的离子方程式为
(2)沉淀物A中除含有Fe2Q3外,还含有
(3)操作①的名称为
(4)用14mol.L-1的浓氨水配制480mL 2mol.L?1稀氨水:
①所用的容量瓶规格是
②稀释浓氨水用的烧杯和玻璃棒如何洗涤?
③下列操作对所配制的稀氨水浓度的影响(填“偏大”、“偏小”或“无影响”
a.洗涤后的容量瓶中有少量蒸馏水:
b.浓氨水量取后,所用的量筒用蒸馏水洗涤2?3次,并将洗涤液转人容量瓶中:.
(5)确定钾氮复合肥中含有钾元素的方法是.
(6)为测定钾氮复合肥中氮元素的质量分数,称取mg钾氮复合肥,加人足量的NaOH浓溶液加热,使产生 的气体全部逸出,收集到的氨气折箅成标准状况下的体积为V mL.则钾氮复合肥中氮元索的质量分数为
考点:金属的回收与环境、资源保护
专题:实验设计题,元素及其化合物
分析:含有Al2O3和少量的Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al2O3、Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子,则操作1为蒸发结晶得到硫酸钾晶体.
(1)明矾石加入足量的稀氨水中浸出时铝离子会和氨水之间反应;
(2)Al2O3和Fe2O3、Al(OH)3都和氨水之间不反应;
(3)溶液蒸发浓缩、冷却结晶、过滤可以得到其晶体物质;
(4)配制480mL溶液,应选择500mL容量瓶;根据洗涤仪器的方法来进行;根据c=
来确定引起的误差;
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应;
(6)根据元素守恒来计算.
(1)明矾石加入足量的稀氨水中浸出时铝离子会和氨水之间反应;
(2)Al2O3和Fe2O3、Al(OH)3都和氨水之间不反应;
(3)溶液蒸发浓缩、冷却结晶、过滤可以得到其晶体物质;
(4)配制480mL溶液,应选择500mL容量瓶;根据洗涤仪器的方法来进行;根据c=
| n |
| V |
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应;
(6)根据元素守恒来计算.
解答:
解:含有Al2O3和少量的Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀A中含Al2O3、Fe2O3、Al(OH)3,溶液中含钾离子、硫酸根离子,则操作1为蒸发结晶得到硫酸钾晶体,
(1)明矾石加入足量的稀氨水中浸出时发生反应的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(2)杂质均不溶于氨水,铝离子与氨水反应生成沉淀,沉淀A中含Al2O3、Fe2O3、Al(OH)3,故答案为:Al2O3;Al(OH)3;
(3)由上述分析可知,操作1为蒸发浓缩,故答案为:蒸发浓缩;
(4)①配制480mL溶液,应选择500mL容量瓶,故答案为:500mL容量瓶;
②稀释浓氨水用的烧杯和玻璃棒的洗涤方法:适量的蒸馏水沿着玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2-3次,故答案为:适量的蒸馏水沿着玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2-3次;
③a、洗涤后的容量瓶中有少量蒸馏水,不会影响实验结果,故答案为:无影响;
b、用量筒量取浓氨水后,用蒸馏水洗涤量筒并转移至容量瓶中,溶质增多,浓度偏大,故答案为:偏大,
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素,故答案为:焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素.
(6)足量的NaOH浓溶液加热,使产生 的气体全部逸出,收集到的氨气折箅成标准状况下的体积为VmL,根据N元素守恒,则钾氮复合肥中氮元索的物质的量为
mol,所以钾氮复合肥中氮元索的质量分数为
×100%=
%,故答案为:
%.
(1)明矾石加入足量的稀氨水中浸出时发生反应的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
(2)杂质均不溶于氨水,铝离子与氨水反应生成沉淀,沉淀A中含Al2O3、Fe2O3、Al(OH)3,故答案为:Al2O3;Al(OH)3;
(3)由上述分析可知,操作1为蒸发浓缩,故答案为:蒸发浓缩;
(4)①配制480mL溶液,应选择500mL容量瓶,故答案为:500mL容量瓶;
②稀释浓氨水用的烧杯和玻璃棒的洗涤方法:适量的蒸馏水沿着玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2-3次,故答案为:适量的蒸馏水沿着玻璃棒注入烧杯中,倾斜转动烧杯,洗涤烧杯内壁后将洗涤液转入容量瓶中,重复操作2-3次;
③a、洗涤后的容量瓶中有少量蒸馏水,不会影响实验结果,故答案为:无影响;
b、用量筒量取浓氨水后,用蒸馏水洗涤量筒并转移至容量瓶中,溶质增多,浓度偏大,故答案为:偏大,
(5)确定钾氮复合肥中含有钾元素的方法是焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素,故答案为:焰色反应,透过蓝色钴玻璃观察到紫色火焰,则含钾元素.
(6)足量的NaOH浓溶液加热,使产生 的气体全部逸出,收集到的氨气折箅成标准状况下的体积为VmL,根据N元素守恒,则钾氮复合肥中氮元索的物质的量为
| V×10-3 |
| 22.4 |
| V×10-3×14 |
| 22.4m |
| 7V |
| 112m |
| 7V |
| 112m |
点评:本题考查较综合,涉及物质制备实验方案的设计及溶液配制,把握实验流程中发生的反应及分离方法为解答的关键,侧重分析能力及迁移应用能力的考查,题目难度中等.

练习册系列答案
相关题目
最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4?5H2O.实验结果如下下列关于这一过程的叙述错误的是( )
| 沸腾炉炉度/℃ | 560 | 580 | 600 | 620 | 640 | 660 | |
| 生成物 | 水溶性Cu% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
| 酸溶性Cu% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 | |
| 酸溶性Fe% | 8.56 | 6.72 | 3.46 | 2.78 | 2.37 | 2.28 | |
| A、反应中有二氧化硫生成 |
| B、产物中铜元素主要以氧化物形式存在 |
| C、随温度升高,铁的氧化物在酸中的溶解度降低 |
| D、温度高于600~620℃生成物中水溶性Cu(%)下降的原因是水溶性铜分解所致 |
 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )①C、CO ②AlCl3、Al(OH)3 ③Na、Na2O ④NaOH、Na2CO3.
| A、①②③ | B、①② |
| C、③④ | D、①②③④ |
下列物质的鉴别方法正确的是( )
| A、用澄清石灰水鉴别氢气和一氧化碳 |
| B、用无色酚酞鉴别碳酸钠溶液和氢氧化钠溶液 |
| C、用食盐水鉴别硬水和软水 |
| D、用水鉴别硝酸铵固体和氢氧化钠固体 |
下列说法正确的是( )
| A、不用其它试剂便无法区别NaCl、Na2CO3、NaHSO4、AlCl3四种溶液 |
| B、纤维素水解与淀粉水解得到的最终产物不同 |
| C、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量相等 |
| D、用渗析的方法精制氢氧化铁胶体 |



