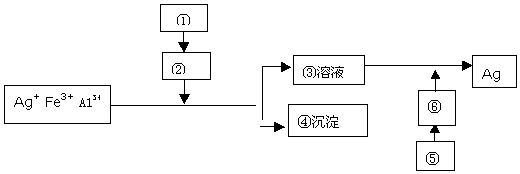
题目内容
2.元素X、Y的原子序数之和为21,X3+与Y2-具有相同的核外电子排布,下列推测正确的是( )| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径:X>Y,离子半径:X3+>Y2- | |
| C. | 同族元素中Y的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
分析 X3+与Y2-具有相同的核外电子排布,元素X、Y的原子序数之和为21,可知原子序数分别为13、8,则X为Al、Y为O,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为Al、Y为O,
A.同周期元素从左到右金属性逐渐减弱,第三周期中Na的金属性最强,故A错误;
B.具有相同的核外电子排布,核电荷数越大离子半径越小,X3+<Y2-,故B错误;
C.同主族元素从上到下,元素的非金属性逐渐减弱,非金属性越强,对应的氢化物越稳定,故C正确;
D.Y为O元素,不存在正价,故D错误.
故选C.
点评 本题考查原子结构与元素周期律、元素性质关系,为高频考点,侧重考查分析推断能力,注意规律中的反常现象,易错选项是D,注意O、F元素没有正化合价.

练习册系列答案
相关题目
13.根据元素周期表和元素周期律,分析下面的推断,其中错误的是( )
| A. | 铍的原子失电子能力比镁弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒的原子半径比硫小 | D. | Sr(OH)2 比Ca(OH)2 碱性强 |
10.主族元素镓(Ga)的原子结构示意图是: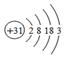 ,下列关系不正确的是( )
,下列关系不正确的是( )
 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH)3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
17.下列说法正确的是( )
| A. | 金刚石和石墨互为同素异形体,熔点和硬度都很高 | |
| B. | 氕、氘、氚是氢元素的三种核素,质子数都是1 | |
| C. | 乙醇和二甲醚(CH3-O-CH3)互为同系物 | |
| D. | C4H10的一氯代物只有一种 |
7.Mg、Ca、Sr、Ba是按原子序数由小到大的顺序排列的第ⅡA族元素.已知:①Mg(OH)2难溶于水,而Ca(OH)2微溶于水;②MgSO4溶于水,而CaSO4微溶于水.下列推测中,不正确的是( )
| A. | Sr(OH)2溶解于水 | B. | SrSO4难溶于水 | ||
| C. | BaSO4不溶于水 | D. | Ba(OH)2比Ca(OH)2更难溶于水 |
7.研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
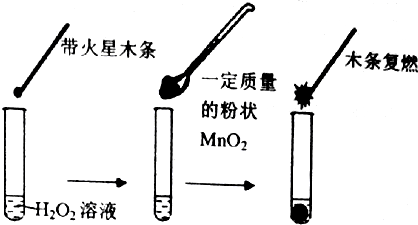
(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂. 该实验不能 (填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.(若能,不必回答原因)
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
由此得到的结论是Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好,设计实验Ⅲ的目的是对比实验,证明Cl-对H2O2的分解没有催化作用.
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).

(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂. 该实验不能 (填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.(若能,不必回答原因)
(2)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL5%H2O2)
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(3)在上述实验过程中,分别检测出溶液中有二价铁生成,查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).
4.下列关于碳原子的成键特点及成键方式的理解,正确的是( )
| A. | 饱和机物中碳原子不能发生化学反应 | |
| B. | C原子只能与C原子形成不饱和键 | |
| C. | 任何有机物中H原子数目不可能为奇数 | |
| D. | 五个C原子之间能够形成五个碳碳单键 |
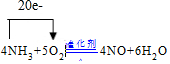 .
.