题目内容
恒容容器中,2SO2(g) + O2(g) 2SO3 (g) △H=-296.6kJ/mol,下列判断不正确的是
2SO3 (g) △H=-296.6kJ/mol,下列判断不正确的是
A.2体积SO2和足量O2反应,一定不能生成2体积SO3
B.其他条件不变,增大压强,正反应速率增大逆反应速率也增大
C.加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍
D.平衡后再加入1molSO3,SO2的转化率增大
练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
2.氢、氧两种元素组成的常见物质有H2O和H2O2,二者在一定条件下均可分解.
(1)已知:
①H2O的电子式是 .
.
②H2O(g)分解的热化学方程式是2H2O(g)=2H2(g)+O2(g)△H=+482KJ/mol.
③11.2L(标准状况)的H2完全燃烧,生成气态水,放出120.5kJ的热量.
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响.常温下,按照如表所示的方案完成实验.
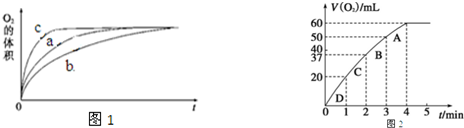
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示.由该图能够得出的实验结论是
其他条件不变时,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率.
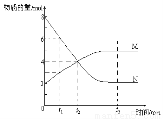
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示.解释反应速率变化的原因
随着反应的进行,H2O2的浓度逐渐减小,H2O2的分解速率逐渐减慢;计算H2O2的初始物质的量浓度为0.11 mol•L-1 (保留两位有效数字).
(1)已知:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
 .
.②H2O(g)分解的热化学方程式是2H2O(g)=2H2(g)+O2(g)△H=+482KJ/mol.
③11.2L(标准状况)的H2完全燃烧,生成气态水,放出120.5kJ的热量.
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响.常温下,按照如表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol•L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |
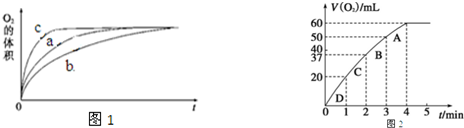
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示.由该图能够得出的实验结论是
其他条件不变时,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率.
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示.解释反应速率变化的原因
随着反应的进行,H2O2的浓度逐渐减小,H2O2的分解速率逐渐减慢;计算H2O2的初始物质的量浓度为0.11 mol•L-1 (保留两位有效数字).
3.已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是( )
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的Ksp比在20 mL 0.01 mol•L-1 NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,向二者的饱和溶液中分别加水,平衡均向沉淀溶解方向移动,c(Mg2+)均增大 |


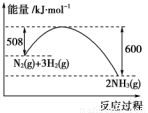
 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下: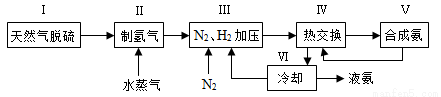
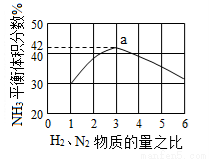
 2NH3(g),能说明反应已达到平衡状态的是
2NH3(g),能说明反应已达到平衡状态的是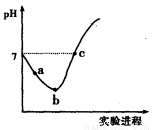
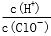 减小
减小