题目内容
10.下列化学变化中,需加入氧化剂才能实现的是( )| A. | CO2→CO | B. | ZnCl2→Zn | C. | KI→I2 | D. | SO3→H2SO4 |
分析 需加入氧化剂才能实现,则选项中为还原剂发生的变化,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.C元素化合价降低,被还原,应加入还原剂,故A错误;
B.Zn元素化合价降低,被还原,应加入还原剂,故B错误;
C.I元素化合价升高,被氧化,应加入氧化剂,故C正确;
D.元素化合价没有发生变化,不是氧化还原反应,故D错误.
故选C.
点评 本题考查氧化还原反应,侧重考查基本概念,明确元素化合价变化与氧化剂、还原剂关系即可解答,熟悉常见元素化合价,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
1.某小组同学欲探究0.1mol/L Fe3+溶液与 0.1mol/L S2-溶液的反应.小组同学先进行理论预测,提出如下三种可能:
a. Fe3+与 S2-发生复分解反应
b. Fe3+与 S2-发生氧化还原反应
c. Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式2Fe3++3S2-=Fe2S3↓
(2)将预测b补充完整氧化还原,说明预测依据Fe3+中Fe元素处于高价,可以降低,体现氧化性;S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应.
在进行实验验证前,先进行资料收集,得到如表信息:
进行如表实验:
(3)写出黑色沉淀转变为黄色沉淀的离子方程式Fe2S3+4Fe3+=3S↓+6Fe2+.为进一步探究反应实质,该组同学进行了如下实验:
(4)步骤4与步骤1现象不同的原因可能是Fe3+量不足,不能氧化Fe2S3,而且体系中S2-不能还原Fe2S3,所以不能生成S
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS.请判断他的想法是否合理并说明理由合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS
(6)依据以上实验现象,可得出结论:Fe3+与S2-发生复分解反应.
a. Fe3+与 S2-发生复分解反应
b. Fe3+与 S2-发生氧化还原反应
c. Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式2Fe3++3S2-=Fe2S3↓
(2)将预测b补充完整氧化还原,说明预测依据Fe3+中Fe元素处于高价,可以降低,体现氧化性;S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应.
在进行实验验证前,先进行资料收集,得到如表信息:
| 物质 | 颜色 | 水中溶解性 |
| Fe2S3 | 黑色 | 难溶于水 |
| FeS | 黑褐色 | 难溶于水 |
| 实验步骤 | 操作 | 现象 | 备注 |
| 1 | 向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液 | 产生黑色沉淀,立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
| 2 | 继续滴加3滴0.1mol/L 硫化钠溶液 | 同上 | |
| 3 | 继续滴加0.1mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
| 实验步骤 | 操作 | 现象 |
| 4 | 向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
| 5 | 继续滴加3滴0.1mol/L 氯化铁溶液 | 同上 |
| 6 | 继续滴加0.1mol/L 氯化铁溶液至过量 | 同上 |
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS.请判断他的想法是否合理并说明理由合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS
(6)依据以上实验现象,可得出结论:Fe3+与S2-发生复分解反应.
18.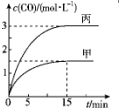 一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.
下列说法正确的是( )
 一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.
一定条件下存在反应C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、丙两个恒容容器中加入一定量C和H2O(g),向乙恒容容器中加入一定量CO和H2,各容器中温度、反应物的起始量如表,甲、丙反应过程中CO的物质的量浓度随时间变化如图.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、 1mol H2O(g) | 1mol CO、 1mol H2 | 4mol C、 2mol H2O(g) |
| A. | 丙容器的容积V<0.5L | |
| B. | 甲容器中,反应在前15 min内的平均反应速率v(H2)=0.15 mol•L-1•min-1 | |
| C. | 当温度为T1℃时,反应的平衡常数K=2.25 | |
| D. | 乙容器中,若平衡时n(H2O)=0.3 mol,则T1<T2 |
2.设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 0.1molCH3+所含的电子数为8NA | |
| B. | T℃时,1L pH=6的纯水中含有1×10-6NA个OH- | |
| C. | 23g NO2和23g N2O4的混合气体所含原子数为3NA | |
| D. | 10g 46%的乙醇的水溶液中所含H原子数为0.6NA |
19.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | 煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源 | |
| B. | 白铁(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应采取深度填埋法 | |
| D. | 测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义 |
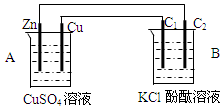 按图装置进行实验,并回答下列问题
按图装置进行实验,并回答下列问题


