题目内容
1.某小组同学欲探究0.1mol/L Fe3+溶液与 0.1mol/L S2-溶液的反应.小组同学先进行理论预测,提出如下三种可能:a. Fe3+与 S2-发生复分解反应
b. Fe3+与 S2-发生氧化还原反应
c. Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式2Fe3++3S2-=Fe2S3↓
(2)将预测b补充完整氧化还原,说明预测依据Fe3+中Fe元素处于高价,可以降低,体现氧化性;S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应.
在进行实验验证前,先进行资料收集,得到如表信息:
| 物质 | 颜色 | 水中溶解性 |
| Fe2S3 | 黑色 | 难溶于水 |
| FeS | 黑褐色 | 难溶于水 |
| 实验步骤 | 操作 | 现象 | 备注 |
| 1 | 向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液 | 产生黑色沉淀,立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
| 2 | 继续滴加3滴0.1mol/L 硫化钠溶液 | 同上 | |
| 3 | 继续滴加0.1mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
| 实验步骤 | 操作 | 现象 |
| 4 | 向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
| 5 | 继续滴加3滴0.1mol/L 氯化铁溶液 | 同上 |
| 6 | 继续滴加0.1mol/L 氯化铁溶液至过量 | 同上 |
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS.请判断他的想法是否合理并说明理由合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS
(6)依据以上实验现象,可得出结论:Fe3+与S2-发生复分解反应.
分析 (1)Fe3+与 S2-发生复分解反应生成Fe2S3;
(2)根据Fe3+中Fe元素处于高价,具有强氧化性,S2-中S元素处于低价,具有强还原性,可发生氧化还原反应判断;
(3)步骤1向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液,氯化铁溶液过量,产生黑色沉淀即为Fe2S3,立即变为黄色沉淀即S,说明Fe2S3被过量的氯化铁溶液氧化成硫单质;
(4)步骤4向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液,氯化铁溶液少量,不能将Fe2S3氧化成硫单质,而且体系中S2-不能还原Fe2S3生成S;
(5)步骤3向2mL 0.1mol/L氯化铁溶液中逐滴滴入0.1mol/L 硫化钠溶液至过量,产生黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,则生成的Fe2+可能直接与S2-生成FeS沉淀;
(6)综合以上分析解答,可得出结论:Fe3+与 S2-发生复分解反应.
解答 解:(1)Fe3+与 S2-发生复分解反应生成Fe2S3,离子方程式为:2Fe3++3S2-=Fe2S3↓,故答案为:2Fe3++3S2-=Fe2S3↓;
(2)因为Fe3+中Fe元素处于高价,具有强氧化性,S2-中S元素处于低价,具有强还原性,可发生氧化还原反应,故答案为:氧化还原反应; Fe3+中Fe元素处于高价,可以降低,体现氧化性; S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应;
(3)步骤1向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液,氯化铁溶液过量,首先产生黑色沉淀即为Fe2S3,立即变为黄色沉淀即S,说明Fe2S3被过量的氯化铁溶液氧化成硫单质,则黑色沉淀转变为黄色沉淀的离子方程式为:Fe2S3+4Fe3+=3S↓+6Fe2+,故答案为:Fe2S3+4Fe3+=3S↓+6Fe2+;
(4)步骤4向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液,氯化铁溶液少量,不能将Fe2S3氧化成硫单质,而且体系中S2-不能还原Fe2S3生成S,所以只产生黑色沉淀,未见其它明显现象,则步骤4与步骤1现象不同的原因可能是Fe3+量不足,不能氧化Fe2S3,而且体系中S2-不能还原Fe2S3,所以不能生成S,故答案为:Fe3+量不足,不能氧化Fe2S3,而且体系中S2-不能还原Fe2S3,所以不能生成S;
(5)步骤3向2mL 0.1mol/L氯化铁溶液中逐滴滴入0.1mol/L 硫化钠溶液至过量,产生黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,则开始Fe3+氧化Fe2S3生成的Fe2+可能直接与S2-生成FeS沉淀,所以步骤3中产生的黑色沉淀中可能有FeS,故答案为:合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS;
(6)综合以上分析解答,可得出结论:Fe3+与 S2-发生复分解反应,故答案为:Fe3+与 S2-发生复分解反应.
点评 本题考查了Fe3+与 S2-之间的反应探究,题目难度中等,注意掌握实验方案设计与评价的原则,试题培养了学生的分析能力及化学实验能力.

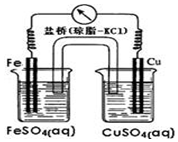
| A. | 铜作正极,发生氧化反应 | |
| B. | 外电路中电流方向为Fe→Cu | |
| C. | Fe电极的电极反应式为Fe-3e-=Fe3+ | |
| D. | 盐桥将两电解质溶液连接起来,传导电流,通过等量的K+和Cl-的定向移动,使两电解质溶液保持电中性 |
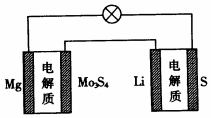 已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )
已知:镁电池的总反应为xMg+Mo3S4$?_{放电}^{充电}$MgxMo3S4,锂硫电池的总反应为2Li+S$?_{放电}^{充电}$Li2S.下列说法正确的是( )| A. | 镁电池放电时,Mg2+向负极迁移 | |
| B. | 镁电池放电时,正极发生的电极反应为Mo3S4+2xe-=Mo3S42- | |
| C. | 理论上两种电池的比能量相同(参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量) | |
| D. | 图中Li作负极,Mo3S4作阳极 |
| A. | B. | C. | D. |
| 《神农本草经》记载,麻黄能“止咳逆上气” | 胃舒平药片 (复方氢氧化铝)  |  |  秦朝彩俑 |
| 古代中国人已用麻黄治疗咳嗽 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 古代中国人掌握化学制颜料方法 |
| A. | A | B. | B | C. | C | D. | D |
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
| A. | CO2→CO | B. | ZnCl2→Zn | C. | KI→I2 | D. | SO3→H2SO4 |
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |