题目内容
7.明矾石和碱式碳酸铝镁[MgaAlb(OH)c(CO3)d•xH2O]在生产生活中都有着极为重要的应用.某研究小组对用明矾石制取氢氧化铝等物质,以及碱式碳酸铝镁的组成展开了如下研究,请你参与并完成对有关问题的解答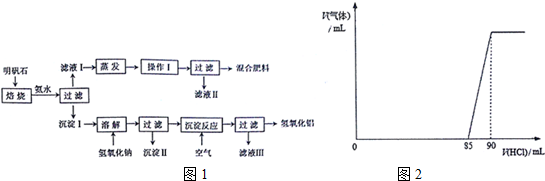
(1)明矾石是制取化肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如图1所示:
①操作I的名称为冷却结晶
②混合肥料的主要成分是K2SO4、(NH4)2SO4(写化学式).检验滤液Ⅱ中是否含有NH4+的方法是:取少货滤液Ⅱ于试管中,向其中加入适量的NaOH溶液,加热,若产生气体能够使湿润的红色石蕊试纸变蓝,则证明滤液Ⅱ中含有NH4+
③一定条件下,下列物质能与沉淀Ⅱ发生反应的是b(填字母)•
a.KSCN 溶液 b.Al c.NaOH 溶液
④空气能够为沉淀反应提供足量的CO2(写化学式).
(2)碱式碳酸铝镁是常见胃药“达喜”的主要成分.为确定碱式碳酸铝镁的组成,进行了如下实验:
①取碱式碳酸铝镁粉末6.02g,缓缓加入2.0mol•L-1盐酸使其充分混合反应,反应过程中产生气体的体积V(气体)和消耗盐酸的体积V(HC1)的关系如图2所示,则碱式碳酸铝镁中氢氧根与碳酸根的物质的量之比为16:1
②将①反应后得到的混合液再和过量的氢氧化钠溶液充分混合,反应完全后经过过滤、洗涤、干燥得沉淀3.48g,则碱式碳酸铝镁的化学式为Mg6Al2(OH)16CO3•4H2O.
分析 (1)明矾石含有Al2O3和Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀I中含Al2O3、Fe2O3、Al(OH)3,溶液I中含钾离子、铵根离子、硫酸根离子,滤液经过蒸发浓缩、冷却结晶、过滤得到硫酸钾、硫酸铵晶体.Al2O3、Fe2O3、Al(OH)3中加入氢氧化钠,Fe2O3与氢氧化钠不反应,Al2O3、氢氧化铝与氢氧化钠反应:Al(OH)3+NaOH═NaAlO2+2H2O,Al2O3+2NaOH═2NaAlO2+H2O,滤液中含有NaAlO2溶液,沉淀Ⅱ为氧化铁,滤液中通入足量的空气,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,再过滤得到氢氧化铝,溶液Ⅲ中含有NaHCO3.
(2)①加入盐酸,第一阶段反应本质为:OH-+H+=H2O、CO32-+H+=HCO3-;生成气体的反应本质为:HCO3-+H+=CO2↑+H2O,结合消耗盐酸计算n(OH-)、n(CO32-);
②加入过量的氢氧化钠溶液,反应完全后经过过滤、洗涤、干燥得沉淀3.48g为氢氧化镁的质量,根据n=$\frac{m}{M}$计算n[Mg(OH)2],达喜中n(Mg2+)=n[Mg(OH)2],利用电荷守恒2n(Mg2+)+3n(Al3+)=n(OH-)+2n(CO32-)计算n(Al3+),根据结合样品质量求得水的质量,再根据根据n=$\frac{m}{M}$计算n(H2O),据此确定n(Mg2+):n(Al3+):n(OH-):n(CO32-):n(H2O),据此书写化学式.
解答 解:(1)明矾石含有Al2O3和Fe2O3等杂质,加足量的稀氨水,明矾石中的铝离子与氨水反应,过滤后沉淀I中含Al2O3、Fe2O3、Al(OH)3,溶液I中含钾离子、铵根离子、硫酸根离子,滤液经过蒸发浓缩、冷却结晶、过滤得到硫酸钾、硫酸铵晶体.Al2O3、Fe2O3、Al(OH)3中加入氢氧化钠,Fe2O3与氢氧化钠不反应,Al2O3、氢氧化铝与氢氧化钠反应:Al(OH)3+NaOH═NaAlO2+2H2O,Al2O3+2NaOH═2NaAlO2+H2O,滤液中含有NaAlO2溶液,沉淀Ⅱ为氧化铁,滤液中通入足量的空气,发生反应:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,再过滤得到氢氧化铝,溶液Ⅲ中含有NaHCO3.
①操作I是从溶液中获得晶体,需要结构蒸发浓缩、冷却结晶、过滤等操作,
故答案为:冷却结晶;
②由上述分析可知,混合肥料的主要成分是K2SO4、(NH4)2SO4,检验滤液Ⅱ中是否含有NH4+的方法是:取少货滤液Ⅱ于试管中,向其中加入适量的NaOH溶液,加热,若产生气体能够使湿润的红色石蕊试纸变蓝,则证明滤液Ⅱ中含有NH4+,
故答案为:K2SO4、(NH4)2SO4;湿润的红色石蕊试纸变蓝;
③沉淀Ⅱ为氧化铁,Al能与氧化铁发生铝热反应,
故选:b;
④空气能够为沉淀反应提供足量的:CO2,
故答案为:CO2;
(2)①加入盐酸,第一阶段反应本质为:OH-+H+=H2O、CO32-+H+=HCO3-;生成气体的反应本质为:HCO3-+H+=CO2↑+H2O,生成二氧化碳消耗盐酸(90-85)mL=5mL,则n(CO32-)=n(HCO3-)=0.005L×2mol/L=0.01mol,故n(OH-)=0.085L×2mol/L-0.01mol=0.16mol,故
则碱式碳酸铝镁中n(OH-):n(CO32-)=0.16mol:0.01mol=16:1,
故答案为:16:1;
②加入过量的氢氧化钠溶液,反应完全后经过过滤、洗涤、干燥得沉淀3.48g为氢氧化镁的质量,则n[Mg(OH)2]=$\frac{3.48g}{58g/mol}$=0.06mol,达喜中n(Mg2+)=n[Mg(OH)2]=0.06mol,
利用电荷守恒2n(Mg2+)+3n(Al3+)=n(OH-)+2n(CO32-),故3n(Al3+)=0.16mol+0.01mol×2-0.06mol×2=0.06mol,故n(Al3+)=0.02mol,
故:m(CO32-)=0.01 mol×60 g•mol-1=0.6 g
m(OH-)=0.16 mol×17 g•mol-1=2.72 g
m(Mg2+)=0.06 mol×24 g•mol-1=1.44 g
m(Al3+)=0.02 mol×27 g•mol-1=0.54 g
所以,m(H2O)=6.02g-0.6g-2.72g-1.44g-0.54g=0.72g,故n(H2O)=$\frac{0.72g}{18g/mol}$=0.04 mol
则n(Mg2+):n(Al3+):n(OH-):n(CO32-):n(H2O)=0.02:0.06:0.16:0.01:0.04=6:2:16:1:4,达喜的组成为Mg6Al2(OH)16CO3•4H2O,
故答案为:Mg6Al2(OH)16CO3•4H2O.
点评 本题考查化学工艺流程、物质的分离提纯、离子检验、物质组成的测定等,(2)中涉及反应较多、计算量较大,为易错题目,明确各阶段发生的反应是解题关键,侧重考查学生对于实验数据的分析处理能力,注意守恒思想的运用.

| A. | 乙炔的结构简式CHCH | B. | 羟基的电子式 | ||
| C. | 乙酸的分子式C2H4O2 | D. | 乙醇的结构式CH3CH2OH |
| A. | NaHCO3 | B. | P2O5 | C. | HClO4 | D. | KOH |
| A. | Mn02是还原剂 | B. | HCl被氧化 | ||
| C. | Mn02发生氧化反应 | D. | 4molHCl参加反应则转移4mol电子 |
| A. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO | B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | ||
| C. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | D. | Ca(OH)2$\stackrel{Cl_{2}}{→}$Ca(ClO)2$\stackrel{SO_{2}}{→}$HClO |
| A. | 离子键 | B. | 共价键 | C. | 金属键 | D. | 分子间力 |
| A. | NaOH | B. | CH3COONa | C. | NH4Cl | D. | NaHSO4 |

 .
.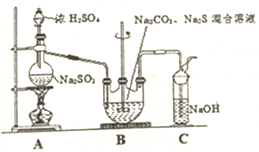 硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图: