题目内容
下列物质的制备合理的是( )
①将氯化铝与硫化钾溶液混合后过滤来制备硫化铝
②将过量的铁与氯气加热反应制备氯化亚铁
③在配制的硫酸亚铁溶液常加入一定量的铁粉和硫酸
④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜
⑤将45mL水加入到盛有5g氯化钠的烧杯中,溶解配制50g质量分数为5%的氯化钠溶液.
①将氯化铝与硫化钾溶液混合后过滤来制备硫化铝
②将过量的铁与氯气加热反应制备氯化亚铁
③在配制的硫酸亚铁溶液常加入一定量的铁粉和硫酸
④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜
⑤将45mL水加入到盛有5g氯化钠的烧杯中,溶解配制50g质量分数为5%的氯化钠溶液.
| A、只有④ | B、只有②③ |
| C、只有③④ | D、全部 |
考点:盐类水解的应用,配制一定溶质质量分数、物质的量浓度溶液的方法,氯气的化学性质
专题:
分析:①AlCl3和K2S能发生双水解生成Al(OH)3和H2S;
②铁在氯气中燃烧生成FeCl3;
③亚铁离子易被氧化且易水解导致溶液呈酸性;
④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜,防止产生污染;
⑤将45mL水加入到盛有5g氯化钠的烧杯中,溶液的质量分数为10%.
②铁在氯气中燃烧生成FeCl3;
③亚铁离子易被氧化且易水解导致溶液呈酸性;
④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜,防止产生污染;
⑤将45mL水加入到盛有5g氯化钠的烧杯中,溶液的质量分数为10%.
解答:
解:①AlCl3和K2S能发生双水解生成Al(OH)3和H2S,所以得不到硫化铝,铝在S蒸气中燃烧生成硫化铝,故错误;
②无论铁是否过量,铁在氯气中燃烧生成FeCl3,铁和稀盐酸反应生成氯化亚铁,故错误;
③亚铁离子易被氧化生成铁离子,亚铁离子易水解导致溶液呈酸性,所以为防止亚铁离子被氧化、水解,在配制的硫酸亚铁溶液常加入一定量的铁粉和硫酸,故正确;
④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜,如果用铜和浓硫酸制取硫酸铜,会产生二氧化硫而产生污染,故正确;
⑤将45mL水加入到盛有5g氯化钠的烧杯中,水的质量为45g,溶液的质量分数=
×100%=10%,故错误;
故选C.
②无论铁是否过量,铁在氯气中燃烧生成FeCl3,铁和稀盐酸反应生成氯化亚铁,故错误;
③亚铁离子易被氧化生成铁离子,亚铁离子易水解导致溶液呈酸性,所以为防止亚铁离子被氧化、水解,在配制的硫酸亚铁溶液常加入一定量的铁粉和硫酸,故正确;
④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜,如果用铜和浓硫酸制取硫酸铜,会产生二氧化硫而产生污染,故正确;
⑤将45mL水加入到盛有5g氯化钠的烧杯中,水的质量为45g,溶液的质量分数=
| 5g |
| (45+5)g |
故选C.
点评:本题考查盐类水解、物质的制备、质量分数的计算等知识点,明确物质的性质是解本题关键,注意铁在氯气中燃烧产物,知道哪些物质之间易发生双水解,题目难度不大.

练习册系列答案
相关题目
能实现Al3++3AlO2-+6H2O=4Al(OH)3↓过程的是( )
| A、向铝盐溶液中不断滴加氢氧化钠溶液 |
| B、向偏铝酸盐溶液中不断加入盐酸 |
| C、向偏铝酸钠溶液中不断通入二氧化碳气体 |
| D、向氢氧化钠溶液中不断滴加铝盐溶液 |
室温时,0.1mol?L-1的HA溶液的pH=3,向该溶液中逐滴加入0.1mol?L-1 NaOH溶液,在滴加过程中,有关叙述正确的是( )
| A、未加入NaOH溶液时,原HA溶液中c(H+)=c(OH-)+c(A-) |
| B、向原溶液中滴入少量NaOH溶液,离子浓度可能为:c(A-)>c(Na+)>c(H+)>c(OH-) |
| C、当滴入的NaOH与HA恰好完全中和时,溶液中c(Na+)=c(A-) |
| D、当加入过量的NaOH溶液时,溶液可能呈中性,也可能呈碱性 |
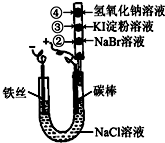 某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )
某化学兴趣小组按如图所示的装置进行实验,玻璃管内装有滴有不同溶液的白色棉球.实验过程中,两极均有气体生成.则下列说法错误的是( )| A、碳棒的电极反应式为2Cl--2e-=Cl2↑ | ||||
| B、②处、③处白色棉球分别变为橙黄色、蓝色 | ||||
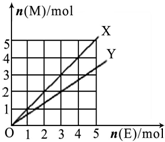
C、如图X、Y两条线分别表示常见的非金属单质和金属单质(用M表示)与碳棒电解产物单质E在点燃条件下进行化合反应的物质的量之间的关系.写出符合Y线反应的化学方式Mg+Cl2
 | ||||
| D、在20℃时饱和食盐水的质量分数为26%,当阳极析出1.12L(标准状况下)气体时,Cl-完全放电.试计算要使溶液恢复原状态,需加入3.65gHCl气体 |
下列叙述正确的是( )
| A、醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | ||
| B、物质的量浓度均为0.01 mol?L-1的CH3COOH和CH3COONa的混合溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol?L-1 | ||
| C、1.0×10-3 mol?L-1盐酸的pH=3.0,1.0×10-8mol?L-1盐酸的pH=8.0 | ||
D、0.1mol?L-1的醋酸溶液中滴加少量烧碱溶液,溶液中
|
氨硼烷(NH3BH3)是储氢量最高的化学氢化物储氢材料之一.室温下,NH3BH3是一种无色分子晶体,其可以与水发生催化脱氢反应:NH3BH3+2H2O
NH4BO2+3H2↑.少量氨硼烷可以由硼烷(B2H6)和NH3合成.下列有关说法正确的是( )
| 催化剂 |
| A、催化脱氢反应中NH3BH3作氧化剂 |
| B、NH4BO2和NH3BH3含有完全相同的化学键 |
| C、0.1 mol NH3BH3发生催化脱氢反应,可以生成6.72 L H2 |
| D、元素N的第一电离能高于相邻元素 |
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与F同主族,E与F同周期.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
| A、A、C两种元素可组成化学式为CA3的化合物 |
| B、F与D形成的化合物性质很不活泼,不与任何酸反应 |
| C、原子半径大小顺序是E<F<C<D |
| D、非金属性强弱顺序是D>C>F>B |
