题目内容
下列叙述正确的是( )
| A、醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | ||
| B、物质的量浓度均为0.01 mol?L-1的CH3COOH和CH3COONa的混合溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol?L-1 | ||
| C、1.0×10-3 mol?L-1盐酸的pH=3.0,1.0×10-8mol?L-1盐酸的pH=8.0 | ||
D、0.1mol?L-1的醋酸溶液中滴加少量烧碱溶液,溶液中
|
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A.加水稀释促进醋酸电离;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.当弱酸接近1.0×10-7mol?L-1时要考虑水的电离;
D.向醋酸中加入少量NaOH溶液,氢氧化钠和氢离子反应导致c(H+)减小,促进醋酸电离.
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.当弱酸接近1.0×10-7mol?L-1时要考虑水的电离;
D.向醋酸中加入少量NaOH溶液,氢氧化钠和氢离子反应导致c(H+)减小,促进醋酸电离.
解答:
解:A.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,pH增大,则a<b,故A错误;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(CH3COOH)+c(CH3COO-)=0.02mol?L-1,故B错误;
C.当弱酸接近1.0×10-7mol?L-1时要考虑水的电离,所以1.0×10-8mol?L-1盐酸要考虑水的电离,溶液的pH小于7,故C错误;
D.向醋酸中加入少量NaOH溶液,氢氧化钠和氢离子反应导致c(H+)减小,促进醋酸电离,c(H+)减小程度大于醋酸电离增大程度,所以溶液中
值减小,故D正确;
故选D.
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(CH3COOH)+c(CH3COO-)=0.02mol?L-1,故B错误;
C.当弱酸接近1.0×10-7mol?L-1时要考虑水的电离,所以1.0×10-8mol?L-1盐酸要考虑水的电离,溶液的pH小于7,故C错误;
D.向醋酸中加入少量NaOH溶液,氢氧化钠和氢离子反应导致c(H+)减小,促进醋酸电离,c(H+)减小程度大于醋酸电离增大程度,所以溶液中
| c(H+) |
| c(CH3COOH) |
故选D.
点评:本题考查弱电解质的电离,明确弱电解质电离影响因素是解本题关键,知道任何电解质溶液中都存在电荷守恒和物料守恒,易错选项是C,注意酸或碱接近中性时要考虑水的电离,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
对于下列装置所示的实验,有关说法正确的是( )
A、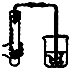 双手移去后,导管中水面与烧杯水面相平,则说明装置不漏气 |
B、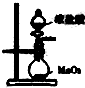 用于实验室制取Cl2 |
C、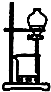 从海带中提取碘的实验过程中,用如图装置向烧杯中放出碘的苯溶液 |
D、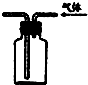 可用于实验室收集甲烷气体 |
下列物质反应后,产物与反应物的量无关的是( )
| A、二氧化碳与石灰水 |
| B、盐酸与偏铝酸钠溶液 |
| C、铝单质和氢氧化钠溶液 |
| D、硫酸铝和氢氧化钡溶液 |
下列物质的制备合理的是( )
①将氯化铝与硫化钾溶液混合后过滤来制备硫化铝
②将过量的铁与氯气加热反应制备氯化亚铁
③在配制的硫酸亚铁溶液常加入一定量的铁粉和硫酸
④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜
⑤将45mL水加入到盛有5g氯化钠的烧杯中,溶解配制50g质量分数为5%的氯化钠溶液.
①将氯化铝与硫化钾溶液混合后过滤来制备硫化铝
②将过量的铁与氯气加热反应制备氯化亚铁
③在配制的硫酸亚铁溶液常加入一定量的铁粉和硫酸
④铜先氧化成氧化铜,再与硫酸反应来制取硫酸铜
⑤将45mL水加入到盛有5g氯化钠的烧杯中,溶解配制50g质量分数为5%的氯化钠溶液.
| A、只有④ | B、只有②③ |
| C、只有③④ | D、全部 |
下列有关溶液组成的描述合理的是( )
| A、无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- |
| B、酸性溶液中可能大量存在Na+、ClO-、SO42-、I- |
| C、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
| D、中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- |
无机化学命名委员会(国际组织)在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,从左到右改为18列,ⅠA族为第1列,0族为第18列. 按此规定,下列说法中错误的是( )
| A、第1列全部是碱金属元素 |
| B、第11列全部由长周期元素组成 |
| C、第3列的元素种类最多 |
| D、第9列元素都是金属元素 |
有关图装置的说法中正确的是( )


| A、若两电极直接连接,e-由外电路流向锌极 |
| B、若锌接电源负极,石墨接电源正极,锌上有气泡 |
| C、若两电极直接连接,则负极反应:Zn-2e-=Zn2+ |
| D、若锌接电源负极,石墨接电源正极,则Cu2+向石墨极移动 |
从2011年5月1日开始施行的《刑法修正案(八)》规定,在道路上醉酒驾驶机动车的,处拘役,并处罚金.我们要切记“开车不喝酒,喝酒不开车”.交通警察检验司机是否酒后驾车的化学原理是:3C2H5OH+2Cr2O72-(橙色)+16H+═3CH3COOH+4Cr3+(绿色)+11H2O.结合上述信息判断有关说法不正确的是( )


| A、乙醇在反应中发生了氧化反应 |
| B、为增强检测效果,加入盐酸酸化重铬酸钾溶液 |
| C、每1 mol乙醇参与反应转移电子物质的量为4mol |
| D、乙醇汽油是一种较清洁能源 |
 某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据:
某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据: