题目内容
把19.2g铜完全溶解于250mL一定浓度的稀硝酸中,待反应结束后再加水稀释到500mL,此时溶液中c(H+)为0.8mol/L,试求:
(1)反应收集的一氧化氮气体在标准状况下的体积;
(2)原稀硝酸的物质的量浓度.
(1)反应收集的一氧化氮气体在标准状况下的体积;
(2)原稀硝酸的物质的量浓度.
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O计算反应消耗的HNO3的物质的量、生成NO的物质的量,根据V=nVm计算NO的体积;
(2)根据n=cV计算反应后剩余硝酸的物质的量,进而计算原溶液中硝酸的物质的量,根据c=
计算原硝酸的浓度.
(2)根据n=cV计算反应后剩余硝酸的物质的量,进而计算原溶液中硝酸的物质的量,根据c=
| n |
| V |
解答:
解:(1)设与 1.92gCu 完全反应需 HNO3的物质的量为x,生成 NO 的物质的量为y,则:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3×64g 8mol 2mol
19.2g x y
所以,3×64g:19.2g=8mol:x,解得x=0.8mol,
3×64g:19.2g=2mol:y,解得y=0.2mol,
故反应生成NO的体积=0.2mol×22.4L/mol=4.48L,
答:生成NO的体积为4.48L.
(2)反应后剩余硝酸的物质的量=0.5L×0.8mol/L=0.4mol,
故原稀硝酸中HNO3的总物质的量=0.8mol+0.4mol=1.2mol,
故原稀硝酸的物质的量浓度=
=4.8mol/L,
答:原稀硝酸的物质的量浓度为4.8mol/L.
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3×64g 8mol 2mol
19.2g x y
所以,3×64g:19.2g=8mol:x,解得x=0.8mol,
3×64g:19.2g=2mol:y,解得y=0.2mol,
故反应生成NO的体积=0.2mol×22.4L/mol=4.48L,
答:生成NO的体积为4.48L.
(2)反应后剩余硝酸的物质的量=0.5L×0.8mol/L=0.4mol,
故原稀硝酸中HNO3的总物质的量=0.8mol+0.4mol=1.2mol,
故原稀硝酸的物质的量浓度=
| 1.2mol |
| 0.25L |
答:原稀硝酸的物质的量浓度为4.8mol/L.
点评:本题考查化学方程式的计算,侧重对基础知识的考查,明确发生的反应即可解答,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
对于在密闭容器中进行的反应:N2+O2?2ΝΟ,下列不能加快该反应的反应速率的条件是( )
| A、缩小体积 |
| B、充入更多的NO |
| C、体积增大到原来的2倍 |
| D、升高温度 |
下列实验或实验改变,不符合化学实验“绿色化”的有( )
(1)在萃取溴水中溴单质的演示实验中,将萃取剂CCl4改为汽油
(2)在铜和浓硝酸反应制取NO2气体的实验中,将铜片改为铜粉
(3)将实验室制取CO2时产生的废液加入适量废碱液中和处理.
(1)在萃取溴水中溴单质的演示实验中,将萃取剂CCl4改为汽油
(2)在铜和浓硝酸反应制取NO2气体的实验中,将铜片改为铜粉
(3)将实验室制取CO2时产生的废液加入适量废碱液中和处理.
| A、只有(1) |
| B、只有(2) |
| C、只有(1)(2) |
| D、只有(3) |
下列说法中正确的是( )
| A、500mL 1mol?L-1 MgCl2溶液中含有Cl-数目为0.5NA |
| B、标准状况下,1mol H2O与1mol O2所占的体积相等 |
| C、1mol S与足量Cu反应生成Cu2S,转移的电子数为NA |
| D、常温常压下,1mol氦气所含的原子数为NA |
 铜及其化合物在工农业生产及日常生活中应用非常广泛.
铜及其化合物在工农业生产及日常生活中应用非常广泛.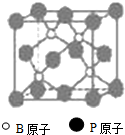 (物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
(物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr. 外,还有
外,还有