题目内容
3.化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
| A. | 该反应的△H=(y-x) kJ/mol | |
| B. | 断裂2molA-B键需要吸收ykJ能量,ykJ是该反应逆反应的活化能 | |
| C. | 2molAB的总键能低于1molA2和1molB2的总键能 | |
| D. | 断裂1mo1A-A键和1molB-B键可放出xkJ的能量 |
分析 由图象可知反应物的总能量大于生成物的总能量,为放热反应,反应热为△H=(x-y) kJ/mol,其中xkJ为反应物的活化能,ykJ是该反应逆反应的活化能,以此解答该题.
解答 解:A.由图象可知反应物的总能量大于生成物的总能量,为放热反应,反应热为△H=(x-y) kJ/mol,故A错误;
B.由图象可知形成2molA-B键需要放出ykJ能量,则断裂2molA-B键需要吸收ykJ能量,且ykJ是该反应逆反应的活化能,故B正确;
C.反应为放热反应,则2molAB的总键能高于1molA2和1molB2的总键能,故C错误;
D.断裂化学键吸收能量,故D错误.
故选B.
点评 本题考查了化学反应与能量变化的关系,题目难度不大,明确化学键断裂、形成过程中发生的能量变化为解答关键,注意掌握化学反应中能量变化的计算方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.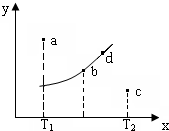 图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
 图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )
图中的曲线是反应2A(g)+B(g)?2C(g)△H=QkJ/mol在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c、d四点,则下列描述正确的是( )| A. | Q<0 | |
| B. | 平衡常数值:b点<d点 | |
| C. | T1温度下若由a点达到平衡,可以采取增大压强的方法 | |
| D. | c点v(正)<v(逆) |
11.下列各组物质的燃烧热相等的是( )
| A. | 碳和一氧化碳 | B. | 1mol 碳和2mol 碳 | ||
| C. | 1mol 乙炔和2mol 碳 | D. | 淀粉和纤维素 |
8.下列各组气体中,相遇会产生白烟的是( )
| A. | NH3和HCl | B. | NH3和O2 | C. | SO3和H2S | D. | NO和O2 |
15.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 7.8 g Na2O2中含有的阴离子数等于0.2NA | |
| B. | 0.1 mol 16OD-离子含有的电子、中子数均为1.0NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
12.查处酒后驾驶采用的“便携式测量仪”是以燃料电池为工作原理,在酸性环境中,乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-=X+2H+.下列说法中正确的是( )
| A. | 燃料电池属于一次电池 | |
| B. | 另一极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在正极发生氧化反应 | |
| D. | 电池总反应为:2CH3CH2OH+O22CH3CHO+2H2O |
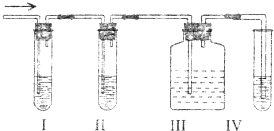 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题: