题目内容
1.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )| A. | He | B. |  | C. | 1s2 | D. | 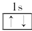 |
分析 原子轨道排布式不仅能表示电子在核外的排布情况,还能表示电子在原子轨道上的自旋情况,对电子运动状态描述最详尽.
解答 解:He是氦元素符号, 表示核外有一个电子层且有2个电子,1s2表示在1S轨道上有2个电子,
表示核外有一个电子层且有2个电子,1s2表示在1S轨道上有2个电子, 表示1S轨道上有2个电子,且自旋相反.
表示1S轨道上有2个电子,且自旋相反.
故选D.
点评 本题考查化学用语,难度不大,注意原子结构示意图、原子轨道排布式的区别.

练习册系列答案
相关题目
18.下列关于苯的叙述正确的是( )


| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| C. | 反应③为取代反应,有机产物是一种烃 | |
| D. | 反应为加成反应,生成物为芳香烃 |
15. X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
①C、CO
②AlCl3、Al(OH)3
③Na、Na2O
④NaOH、Na2CO3
⑤AlO2-、Al(OH)3
⑥Fe、Cl2.
 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )①C、CO
②AlCl3、Al(OH)3
③Na、Na2O
④NaOH、Na2CO3
⑤AlO2-、Al(OH)3
⑥Fe、Cl2.
| A. | ①②⑥ | B. | ①②③④⑤ | C. | ①②③④⑤⑥ | D. | ①②④ |
6. 常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图.下列说法正确的是( )
 常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.05mol/LNaOH溶液分别滴定10.00mL浓度均为0.10mol/LCH3COOH( Ka=l×10-5)溶液HCN(Ka=5×10-10)溶液,所得滴定曲线如图.下列说法正确的是( )| A. | 对两种弱酸滴定均可选用甲基橙作指示剂 | |
| B. | ③处溶液有:c(Na+)=c(CH3COO-)<c(CH3COOH) | |
| C. | 溶液中水的电离程度:②>③>④ | |
| D. | 点①和点②溶液混合后:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
13.下列离子方程式书写正确的是( )
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| B. | 铝粉与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氢氧化铝与氢溴酸 Al(OH)3+3HBr═Al3++3H2O | |
| D. | 过量CO2通入漂白粉溶液中 CO2+H2O+ClO-═HCO3-+HClO |
10.下列说法不正确的是( )
| A. | 石油裂解的目的是为了获得碳原子数少的轻质油 | |
| B. | lmol葡萄糖与足量的金属钠反应,最多可生成2.5molH2 | |
| C. | C3H8和C5Hl2一定互为同系物 | |
| D. | 油脂是食物中产生能量最高的营养物质 |
14.下列化学用语正确的是( )
| A. | 醛基的结构简式-COH | B. | 2-乙基-1,3-丁二烯分子的键线式: | ||
| C. | 丙烷分子的比例模型: | D. | 四氯化碳分子的电子式: |
 材料一:连二亚硫酸钠(Na2S2O4)是一种常用还原剂,俗称保险粉.工业制备方法如下:
材料一:连二亚硫酸钠(Na2S2O4)是一种常用还原剂,俗称保险粉.工业制备方法如下: