题目内容
10.下列说法不正确的是( )| A. | 石油裂解的目的是为了获得碳原子数少的轻质油 | |
| B. | lmol葡萄糖与足量的金属钠反应,最多可生成2.5molH2 | |
| C. | C3H8和C5Hl2一定互为同系物 | |
| D. | 油脂是食物中产生能量最高的营养物质 |
分析 A.石油裂化是提高轻质液体燃料的产量和质量;
B.1mol葡萄糖含5mol羟基;
C.C3H8和C5Hl2都是烷烃;
D.同质量时油脂比糖类含H多,氧化反应中消耗氧气多.
解答 解:A.石油裂化是提高轻质液体燃料特别是汽油的产量和质量,裂解的目的是为了提高乙烯的产量,故A错误;
B.1mol葡萄糖含5mol羟基,则1mol葡萄糖与足量的金属钠反应,最多可生成2.5molH2,故B正确;
C.C3H8和C5Hl2均为烷烃,二者一定互为同系物,故C正确;
D.同质量时油脂比糖类含H多,氧化反应中消耗氧气多,则油脂是食物中产生能量最高的营养物质,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应、有机物的结构为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
6.下列关于碱金属的原子结构和性质的叙述不正确的是( )
| A. | 碱金属元素的原子在化学反应中容易失去电子 | |
| B. | 碱金属单质都是强还原剂 | |
| C. | 碱金属单质都能在O2中燃烧生成过氧化物 | |
| D. | 碱金属单质都能与水反应生成碱 |
1.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
| A. | He | B. |  | C. | 1s2 | D. | 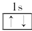 |
5.下列物质间相互发生反应时:①Na+O2②Fe+O2③AgNO3溶液+氨水④HCOOH+Cu(OH)2 ⑤KI溶液+AgNO3溶液 ⑥ ⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )
⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )
 ⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )
⑦Na2CO3+C6H5COOH ⑧AlCl3+KOH ⑨P+Cl2⑩Cu+HNO3;在不同条件下得到不同产物的是( )| A. | 除⑤ | B. | 除②⑤ | C. | 除④⑥ | D. | 除④⑤⑥ |
15.《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列诗词分析不正确的是( )
| A. | 刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到 | |
| B. | 王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应 | |
| C. | 李白诗句“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华的现象 | |
| D. | 曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里“燃豆萁”的能量变化主要是化学能转化为热能 |
5. 二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s),△H=-76.0kJ•mol-1
②3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)△H=-18.7kJ•mol-1
(1)在上述反应中①中,每吸收1molCO2,就有4 molFeO被氧化.
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+38.6kJ/mol
Ⅱ.一定条件下,二氧化碳转化为甲烷.向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)?CH4(g)+2H2O(g).达到平衡时,各物质的浓度分别为CO20.2mol•L-1、CH40.8mol•L-1、H20.8mol•L-1,H2O1.6mol•L-1
(3)在300℃是,将各物质按下列起始浓度(mol•L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是A、D.
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓度D (填字母).
A.c(CH4)=0.8mol•L-1 B.0.8mol•L-1>c(CH4)>1.6mol•L-1
C.c(CH4)=l.6mol•L-1 D.C(CH4)>1.6mol•L-1
(5)在300℃时,如果向该容器中加入CO20.8mol•L-1、H21.0mol•L-1、CH4 2.8mol•L-1、H2O 2.0mol•L-1,则该可逆反应初始时叫v正> v逆 (填“>”或“<”).
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H< 0(填“>”或“<”).
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e-═C+2CO32-,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑.
 二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s),△H=-76.0kJ•mol-1
②3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)△H=-18.7kJ•mol-1
(1)在上述反应中①中,每吸收1molCO2,就有4 molFeO被氧化.
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+38.6kJ/mol
Ⅱ.一定条件下,二氧化碳转化为甲烷.向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)?CH4(g)+2H2O(g).达到平衡时,各物质的浓度分别为CO20.2mol•L-1、CH40.8mol•L-1、H20.8mol•L-1,H2O1.6mol•L-1
(3)在300℃是,将各物质按下列起始浓度(mol•L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是A、D.
| 选项 | CO | H2 | CH4 | H2O |
| A | 0 | 0 | 1 | 2 |
| B | 2 | 8 | 0 | 0 |
| C | 1 | 4 | 1 | .2 |
| D | 0.5 | 2 | 0.5 | 1 |
A.c(CH4)=0.8mol•L-1 B.0.8mol•L-1>c(CH4)>1.6mol•L-1
C.c(CH4)=l.6mol•L-1 D.C(CH4)>1.6mol•L-1
(5)在300℃时,如果向该容器中加入CO20.8mol•L-1、H21.0mol•L-1、CH4 2.8mol•L-1、H2O 2.0mol•L-1,则该可逆反应初始时叫v正> v逆 (填“>”或“<”).
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H< 0(填“>”或“<”).
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e-═C+2CO32-,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑.
2.下列变化过程,属于放热反应的是( )
①铁生锈②碳酸钙高温分解③固体氢氧化钠溶于水④H2在Cl2中燃烧⑤浓硫酸稀释⑥酸碱中和反应.
①铁生锈②碳酸钙高温分解③固体氢氧化钠溶于水④H2在Cl2中燃烧⑤浓硫酸稀释⑥酸碱中和反应.
| A. | ①②④ | B. | ①④⑥ | C. | ①③④⑤⑥ | D. | ⑤⑥ |
3.下列各项化学用语中表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | CH4分子的比例模型 | ||
| C. | 硫离子的结构示意图: | D. | 氮气的电子式  |
