题目内容
16. 材料一:连二亚硫酸钠(Na2S2O4)是一种常用还原剂,俗称保险粉.工业制备方法如下:
材料一:连二亚硫酸钠(Na2S2O4)是一种常用还原剂,俗称保险粉.工业制备方法如下:Ⅰ:把锌块加热到419.5℃时熔化成液态,若向其中鼓入M气体使液态锌雾化,冷却后得到粒度约为180μm的锌粉,加一定量的水形成分散系A,再通入SO2调节到pH为3时制得ZnS2O4溶液.
Ⅱ:向ZnS2O4溶液中加入18%的NaOH溶液得到沉淀和溶液B,再向溶液B中加入NaCl固体后冷却至20℃就制得Na2S2O4固体.
(1)分散系A具有的性质为不稳定(填“稳定”、“较稳定”或“不稳定”).
(2)向溶液B中加入NaCl固体的作用是加入NaCl降低Na2S2O4的溶解度,有利于Na2S2O4析出;
(3)将等体积0.04mo1•L-1AgNO3溶液和0.02mol•L-1碱性Na2S2O4溶液混合,两者恰好完全反应,反应后溶液中有纳米级的银粉生成,写出发生反应的离子方程式2Ag++S2O42-+4OH-=2Ag+2SO32-+2H2O.
材料二:亚铁氰化钾[K4Fe(CN)6•3H2O]俗称黄血盐,易溶于水,与Fe3+反应时生成蓝色的KFe[Fe(CN)6]沉淀,可据此检验Fe3+.
(4)KFe[Fe(CN)6]能与Tl2SO4利用等价离子互换原理实现沉淀转化,用于治疗Tl2SO4中毒(20°C时Tl2SO4的水溶性为4.87g/100mL ).请写出用KFe[Fe(CN)6]治疗Tl2SO4中毒反应的离子方程式KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq).
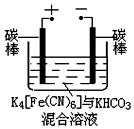
(5)实验室可利用图装置进行K4Fe(CN)6和K3Fe(CN)6的转化.电解过程中:
①阳极的电极反应式为[Fe(CN)6]4--e-=[Fe(CN)6]3-.
②阴极区溶液的pH变大 (填“变大”、“变小”或“不变”).
(6)黄血盐可与酸性高锰酸钾溶液反应,其反应式为:K4Fe(CN)6+KMnO4+H2SO4→KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O有0.5mol K4Fe(CN)6被高锰酸钾氧化,消耗高锰酸钾的物质的量为6.1mol.
分析 (1)把锌块加热到419.5℃时熔化成液态,若向其中鼓入M气体使液态锌雾化,冷却后得到粒度约为180μm的锌粉,冷却后得到粒度约为180μm的锌粉,加一定量的水形成分散系A,则在分散系A中大量存在的是锌粉颗粒,形成的是悬浊液,则分散系A不稳定;
(2)向ZnS2O4溶液中加入18%的NaOH溶液得到沉淀和溶液B,沉淀为Zn(OH)2,溶液B为Na2S2O4溶液,再向溶液B中加入NaCl固体后冷却至20℃就制得Na2S2O4固体,加入NaCl是为了降低Na2S2O4的溶解度,使其更易析出晶体;
(3)等体积0.04mo1/LAgNO3溶液和0.02mol/L碱性Na2S2O4溶液反应,生成纳米级的银粉,可推测反应为氧化还原反应,并且考虑到Na2S2O4是一种常用还原剂,反应生成Ag,SO32-,据此写出方程式;
(4)根据KFe[Fe(CN)6]能与Tl2SO4利用等价离子互换原理实现沉淀转化这一原理,反应为KFe[Fe(CN)6]和Tl+反应生成TlFe[Fe(CN)6]和K+,据此写出反应方程式;
(5)①电解池阳极发生的反应是物质失去电子,发生氧化反应,据此写出阳极的电极反应式;
②阴极区为物质得到电子,发生还原反应,根据装置图,为H2O得到电子,反应生成H2和OH-,据此分析溶液pH变化;
(6)反应方程式为:K4Fe(CN)6+KMnO4+H2SO4→KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O,为氧化还原反应,KMnO4中Mn的化合价降低,发生还原反应,K4Fe(CN)6中Fe,N,C的化合价均升高,发生氧化反应,根据电子得失守恒计算.
解答 解:(1)把锌块加热到419.5℃时熔化成液态,向其中鼓入M气体使液态锌雾化,冷却后得到粒度约为180μm的锌粉,冷却后得到粒度约为180μm的锌粉,加一定量的水形成分散系A,则在分散系A中大量存在的是锌粉颗粒,形成的是悬浊液,悬浊液不稳定,因此分散系A不稳定,
故答案为:不稳定;
(2)向ZnS2O4溶液中加入18%的NaOH溶液得到沉淀和溶液B,沉淀为Zn(OH)2,溶液B为Na2S2O4溶液,再向溶液B中加入NaCl固体后冷却至20℃就制得Na2S2O4固体,加入NaCl是为了降低Na2S2O4的溶解度,使其更易析出晶体,因此向溶液B中加入NaCl固体的作用是加入NaCl降低Na2S2O4的溶解度,有利于Na2S2O4析出,
故答案为:加入NaCl降低Na2S2O4的溶解度,有利于Na2S2O4析出;
(3)等体积0.04mo1/LAgNO3溶液和0.02mol/L碱性Na2S2O4溶液反应,生成纳米级的银粉,考虑到Na2S2O4是一种常用还原剂,反应为一个氧化还原反应,Ag+被还原为Ag,S2O32-被氧化为SO32-,注意反应是在碱性条件下进行,根据电子得失守恒配平方程式,则反应的方程式为:2Ag++S2O42-+4OH-=2Ag+2SO32-+2H2O,
故答案为:2Ag++S2O42-+4OH-=2Ag+2SO32-+2H2O;
(4)KFe[Fe(CN)6]能与Tl2SO4利用等价离子互换原理实现沉淀转化,根据这一原理,反应过程中K+和Tl+是等价离子,二者交换生成TlFe[Fe(CN)6]沉淀,则反应的方程式为:KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq),
故答案为:KFe[Fe(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq);
(5)①电解池阳极发生的反应是物质失去电子,发生氧化反应,装置进行K4Fe(CN)6和K3Fe(CN)6的转化,则为[Fe(CN)6]4-失去电子生成[Fe(CN)6]3-,因此阳极的电极反应方程式为:[Fe(CN)6]4--e-=[Fe(CN)6]3-,
故答案为:[Fe(CN)6]4--e-=[Fe(CN)6]3-;
②阴极区为物质得到电子,发生还原反应,根据装置图,为H2O得到电子,反应生成H2和OH-,电极反应式为:2H2O+2e-═H2↑+2OH-,反应生成了OH-,则电极附近的pH值升高,
故答案为:变大;
(6)黄血盐可与酸性高锰酸钾溶液反应,其反应式为:K4Fe(CN)6+KMnO4+H2SO4→KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O,反应过程中,KMnO4中Mn的化合价降低变成MnSO4,降低5价;K4Fe(CN)6中Fe,N,C的化合价均升高,分别变成Fe2(SO4)3和HNO3和CO2,整体升高1+6×(8+2)=61价,根据电子得失守恒,反应的计量关系为:61KMnO4~~~~~5K4Fe(CN)6,0.5mol K4Fe(CN)6被高锰酸钾氧化,则反应消耗KMnO4的物质的量为0.5mol×$\frac{61}{5}$=6.1mol,
故答案为:6.1mol.
点评 本题考查化学原理部分知识,包含溶液的性质,物质的提纯,氧化还原反应方程式的书写,根据题意书写陌生反应方程式,电化学知识.题目涉及的知识点较多,需要有一定的综合知识能力,题目难度中等.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 液氨可用作制冷剂 | |
| B. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| C. | 用带磨口玻璃塞的试剂瓶盛放Na2CO3溶液 | |
| D. | 光纤通信的光导纤维是由石英经特殊工艺制成的 |
| A. | 相对分子质量最小的化合物是CH2O | |
| B. | 相对分子质量最小的化合物是C2H4O4 | |
| C. | 含相同碳原子数的各化合物,其相对分子质量之差是18的整数倍 | |
| D. | 含相同碳原子数的各化合物均具有相同的碳元素的质量分数 |
| A. | 聚乙烯 | B. | 高吸水性树脂 | C. | 涤纶 | D. | 酚醛树脂 |
| A. | 原电池是把电能转化成化学能的装置 | |
| B. | 原电池内部的阴离子向正极移动 | |
| C. | 原电池的两极分别发生氧化反应和还原反应 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
| A. | 碱金属元素的原子在化学反应中容易失去电子 | |
| B. | 碱金属单质都是强还原剂 | |
| C. | 碱金属单质都能在O2中燃烧生成过氧化物 | |
| D. | 碱金属单质都能与水反应生成碱 |
| A. | He | B. |  | C. | 1s2 | D. | 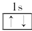 |
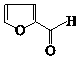 ).通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶.糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成的酚醛树脂,可用作砂轮、砂纸、砂布的黏合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(
).通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶.糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成的酚醛树脂,可用作砂轮、砂纸、砂布的黏合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(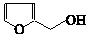 ),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料.
),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料.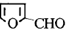 +H2$→_{加热加压}^{CuO-Cr_{2}O_{3}}$
+H2$→_{加热加压}^{CuO-Cr_{2}O_{3}}$
 铁、铜及其化合物在日常生产、生活中有着广泛的应用.回答下列问题:
铁、铜及其化合物在日常生产、生活中有着广泛的应用.回答下列问题: