题目内容
14.在200mLCuSO4的溶液中浸入10g锌片,使溶液中的Cu全部被析出,把锌片及析出的铜取出称量,质量为9.8g,计算CuSO4溶液的物质的量浓度.分析 发生反应Zn+CuSO4=Cu+ZnSO4,根据固体质量差计算参加反应 CuSO4的物质的量,根据c=$\frac{n}{V}$计算浓度.
解答 解:Zn+CuSO4 =Cu+ZnSO4 质量减轻△m
65g 1mol 64g 1g
n (10-9.8)g
n=$\frac{(10-9.8)g×1mol}{1g}$=0.2mol,
c=$\frac{0.2mol}{0.2L}$=1.0mol/L
答:CuSO4溶液的物质的量浓度1.0mol/L.
点评 本题考查根据方程式进行的计算,难度不大,注意利用差量法进行的计算,可以简化计算,差量法的本质为质量守恒.

练习册系列答案
相关题目
5.下列物质满足条件的同分异构体数目错误的是(不考虑立体异构)( )
| 分子式或结构简式 | 满足条件的同分异构体数目 | |
| A | C3H7Cl | 2种 |
| B | C5H12O | 能与金属钠反应的结构有5种 |
| C |  | 一氯代物有2种 |
| D | C5H10O2 | 能与碳酸氢钠溶液反应的结构有4种 |
| A. | A | B. | B | C. | C | D. | D |
5.下列各组离子在溶液中能大量共存的是( )
| A. | NH4+ SO42- NO3- | B. | Ba2+ SO42- NO3- | ||
| C. | Na+ H+ CO32- | D. | Cu2+ OH- Cl- |
9.下列有关表述错误的是( )
| A. | IBr的电子式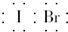 | B. | HClO的结构式为H-O-Cl | ||
| C. | HIO各原子都满足8电子结构 | D. | NaBr的形成过程可以表示为: |
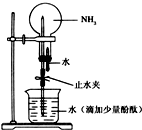 有关氨的实验室制取和性质实验如下:
有关氨的实验室制取和性质实验如下: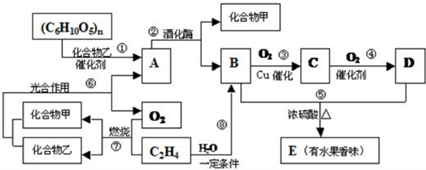
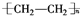 .
. .
.