题目内容
5.两种金属组成的合金6.5g,与氯气完全反应,消耗氯气7.1g,则合金的组成可能是( )| A. | Cu和Zn | B. | Na和Ag | C. | Fe和Ca | D. | Cu和Ca |
分析 设金属为+2价,反应消耗金属的物质的量与氯气的物质的量相等,根据M=$\frac{m}{n}$计算出金属的平均摩尔质量,然后对各选项进行判断;注意+3价金属转化成+2价金属时的摩尔质量=原摩尔质量×$\frac{2}{3}$,+1价金属转化成+2价,其摩尔质量为原摩尔质量的2倍.
解答 解:7.1g氯气的物质的量为$\frac{7.1g}{71g/mol}$=0.1mol,
设金属为+2价,则金属的物质的量为0.1mol,混合金属的平均摩尔质量为:M=$\frac{5.6g}{0.1mol}$=56g/mol,
A.铜的摩尔质量为64g/mol,锌的摩尔质量为65g/mol,二者摩尔质量都大于56g/mol,无法满足平均摩尔质量为56g/mol,故A错误;
B.Na+2价时摩尔质量为:46g/mol,Ag+2价时摩尔质量为:216g/mol,二者的平均摩尔质量可以为56g/mol,故B正确;
C.铁的+2的摩尔质量为:56g/mol×$\frac{2}{3}$≈37.3g/mol,Ca为+2价的摩尔质量为:40g/mol,二者的摩尔质量都小于56g/mol,故C错误;
D.铜的摩尔质量为64g/mol,Ca为+2价的摩尔质量为:40g/mol,二者的平均摩尔质量可以为56g/mol,故D正确;
故选BD.
点评 本题考查了有关混合金属反应的化学计算,题目难度中等,注意掌握平均摩尔质量法在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
13.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )


| A. | 该试剂的物质的量浓度为9.2 mol/L | |
| B. | 该硫酸50 mL若用5 mol/L的氢氧化钠中和,需要该氢氧化钠溶液100毫升 | |
| C. | 该硫酸与等体积的水混合所得溶液的质量分数等于49% | |
| D. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL |
20.在含Na2CO3和NaHCO3各1mol的混合溶液中加入0.5mol下列物质,其中能使HCO3-的数目均减少,CO32-数目增加的是( )
| A. | 浓盐酸 | B. | Na2SO4浓溶液 | C. | NaOH浓溶液 | D. | Ba(OH)2浓溶液 |
10.质量相等的下列物质中,所含原子数最少的是( )
| A. | H2O | B. | NH3 | C. | CH4 | D. | H3PO4 |
17.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 将1mol明矾晶体完全溶于水制成胶体,其中所含胶体粒子数目为NA | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA | |
| C. | 0.1 mol•Lˉ1 CaCl2溶液中含有Clˉ离子的数目为0.2NA | |
| D. | 136g熔融的KHSO4中含有2NA个阳离子 |
14.人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息.
Ⅰ、根据“硫酸亚铁片”标签回答问题
(1)硫酸亚铁片中糖衣的作用是隔绝空气,防止FeSO4被空气氧化.
(2)检验硫酸亚铁片是否被氧化的试剂是KSCN溶液.
(3)硫酸盐中检验SO42-的离子反应方程式是Ba2++SO42-→BaSO4↓.
(4)鉴别中,“加稀盐酸1滴”的作用是B(选填序号)
A.防止亚铁离子被氧化 B、抑制亚铁离子水解
Ⅱ、根据“氢氧化铝片”标签回答问题
(1)能缓解胃酸过多的成分是MgCO3、Al(OH)3.
(2)写出氢氧化铝中和胃酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
(3)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如图所示:
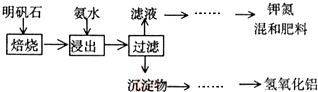
根据上述图示,完成下列填空:
①制备过程中多次用到过滤操作,在实验室中该操作所需的玻璃仪器除了烧杯、漏斗外,还需玻璃棒.
②明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨)78mL,用规格为100mL量筒量取(可供选择的量筒有10mL、50mL、100mL、200mL四种规格).
③写出沉淀物中所有物质的化学式Al(OH)3、Al2O3、Fe2O3.
④为测定明矾石中铝元素的含量,称取m g 明矾石样品按上述流程制得氢氧化铝n g(假设整个流程中既无铝元素损失,也无铝元素的引入),则该明矾石样品中铝元素的质量分数为:$\frac{27n}{78m}$×100% (用含m、n的代数式表示).
| 硫酸亚铁片 英文名:Ferrous Sulfate Tablets 本品含硫酸亚铁(FeSO4•7H2O)应为标示量的95.0%~110.0% | 氢氧化铝片 英文名:Aluminium Hydroxide Tablets |
| 【主要成分】糖衣、碳酸镁、氢氧化铝、淀粉 | |
| 【性状】本品为糖衣,除去糖衣后显淡绿色 | 【适应症】能缓解胃酸过多 |
| 【鉴别】取本品,除去糖衣,称取适量(约相当于硫酸亚铁片0.2g),加稀盐酸1滴与水20ml,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应 | 【用法用量】成人:口服,一次0.6~0.9g(一次2~3片),一日3次,餐前1小时服用 |
| 【详细用法】详见说明书 |
(1)硫酸亚铁片中糖衣的作用是隔绝空气,防止FeSO4被空气氧化.
(2)检验硫酸亚铁片是否被氧化的试剂是KSCN溶液.
(3)硫酸盐中检验SO42-的离子反应方程式是Ba2++SO42-→BaSO4↓.
(4)鉴别中,“加稀盐酸1滴”的作用是B(选填序号)
A.防止亚铁离子被氧化 B、抑制亚铁离子水解
Ⅱ、根据“氢氧化铝片”标签回答问题
(1)能缓解胃酸过多的成分是MgCO3、Al(OH)3.
(2)写出氢氧化铝中和胃酸反应的离子方程式Al(OH)3+3H+=Al3++3H2O.
(3)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如图所示:

根据上述图示,完成下列填空:
①制备过程中多次用到过滤操作,在实验室中该操作所需的玻璃仪器除了烧杯、漏斗外,还需玻璃棒.
②明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨)78mL,用规格为100mL量筒量取(可供选择的量筒有10mL、50mL、100mL、200mL四种规格).
③写出沉淀物中所有物质的化学式Al(OH)3、Al2O3、Fe2O3.
④为测定明矾石中铝元素的含量,称取m g 明矾石样品按上述流程制得氢氧化铝n g(假设整个流程中既无铝元素损失,也无铝元素的引入),则该明矾石样品中铝元素的质量分数为:$\frac{27n}{78m}$×100% (用含m、n的代数式表示).
15. 某实验小组同学探究铜与硝酸的反应.
某实验小组同学探究铜与硝酸的反应.
(1)按不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液与铜片反应,如表:
①铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,若生成标准状况下0.56LNO气体,反应中被还原的HNO3的质量为1.58g
②依据表,制备NO气体最适宜的是实验Ⅱ,理由是产物是NO,反应速率较快(不用加热).
(2)为防止有毒气体逸出造成空气污染,该小组同学改进实验装置,如图所示(夹持仪器略去).用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性.
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触钢丝).
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始.
Ⅳ.当液面重新下降至与铜线脱离接触时,反应停止.
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象.
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水且产生一段高于A管的水柱,若观察到A、B间形成液面差,且保持不变,说明装置气密性良好.
②步骤Ⅲ操作的目的是赶走液面上方空气,防止NO被空气中的O2氧化,以便观察生成气体的颜色.
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是重复步骤Ⅴ的操作(或答“向下移动B管,使A中迅速进入空气,关闭旋塞C,待气体变为红棕色,反复上述操作”).
 某实验小组同学探究铜与硝酸的反应.
某实验小组同学探究铜与硝酸的反应.(1)按不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液与铜片反应,如表:
| 序号 | 浓硝酸与水的体积比 | 实验现象 |
| Ⅰ | 1:1 | 反应速率快,溶液很快变成蓝色,大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1:3 | 反应速率快,溶液变成蓝色,大量气泡冒出,气体呈无色 |
| Ⅲ | 1:5 | 反应速率慢,微热后加快,溶液变成蓝色,气泡冒出,气体无色 |
②依据表,制备NO气体最适宜的是实验Ⅱ,理由是产物是NO,反应速率较快(不用加热).
(2)为防止有毒气体逸出造成空气污染,该小组同学改进实验装置,如图所示(夹持仪器略去).用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性.
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触钢丝).
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始.
Ⅳ.当液面重新下降至与铜线脱离接触时,反应停止.
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象.
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水且产生一段高于A管的水柱,若观察到A、B间形成液面差,且保持不变,说明装置气密性良好.
②步骤Ⅲ操作的目的是赶走液面上方空气,防止NO被空气中的O2氧化,以便观察生成气体的颜色.
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是重复步骤Ⅴ的操作(或答“向下移动B管,使A中迅速进入空气,关闭旋塞C,待气体变为红棕色,反复上述操作”).
 .
. ,加聚反应
,加聚反应