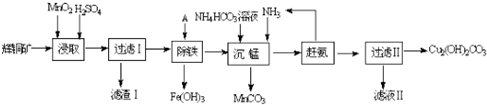
题目内容
9.太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微量的铜、硼、镓、硒等.请回答:
(1)基态Cu2+的核外电子排布式为1s22s22p63s23p63d9;已知高温下Cu20比Cu0更稳定,试从铜原子核外电子结构角度解释其原因亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态.
(2)铜与类卤素(CN)2、(SCN)2反应生成Cu( CN)2、Cu( SCN)2.已知(CN)2分子中各原子最外层均为8电子稳定结构,则l mol (CN)2中含有π键的数目为4NA;
类卤素( SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因为异硫氰酸分子间可形成氢键,而硫氰酸不能.
(3)氮化硼(BN)晶体有多种结构.六方氮化硼是通常存在的稳定结构,与石墨相似,具有层状结构,可作高温润滑剂;立方氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.

①关于两种晶体,下列说法正确的是bc(填选项字母).
a.立方氮化硼含有σ键和π键,所以硬度大
b.六方氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
②立方氮化硼晶体中,硼原子的杂化轨道类型为sp3.
③立方氮化硼晶胞边长为acm,则其密度为$\frac{100}{{a}^{3}N{\;}_{A}}$g/cm3(用含a的代数式表示).
④如图1是金刚石的晶胞图和投影图,图2是立方氮化硼晶胞的投影图,请在图2中圆球上涂“●”和画“×”分别标明B与N的相对位置.

分析 (1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价基态铜离子的电子排布式;原子轨道中电子处于半满、全满、全空时最稳定;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键;
(3)①a.立方相氮化硼中N原子与B原子之间形成单键;
b.六方相氮化硼层间作用力为范德华力;
c.两种晶体中的B-N键均为共价键;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体;
②立方相氮化硼晶体中,硼原子形成4个σ键、没有孤电子对;
③立方氮化硼中,晶胞边长为a pm=a×10-10cm,晶胞体积V=(a×10-10cm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,根据ρ=$\frac{m}{V}$计算密度;
④如图是立方氮化硼晶胞沿z轴的投影图,每个N原子被4个B原子共用、每个B原子被4个N原子共用.
解答 解:(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式为1s22s22p63s23p63d9;原子轨道中电子处于半满、全满、全空时最稳定,二价铜离子价电子排布式为3d9、亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,所以较稳定,
故答案为:1s22s22p63s23p63d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,SCN分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,( SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能;
(3)①a.立方相氮化硼中N原子与B原子之间形成单键,不含π键,属于原子晶体,所以硬度大,故a错误
b.六方相氮化硼层间作用力为范德华力,所以质地软,故b正确;
c.两种晶体中的B-N键均为共价键,故c正确;
d.立方相氮化硼是超硬材料,有优异的耐磨性,属于原子晶体,故d错误,
故选:bc;
②立方相氮化硼晶体中,硼原子形成4个σ键、没有孤电子对,杂化轨道数目为4,采取sp3杂化,
故答案为:sp3;
③立方氮化硼中,晶胞边长为a cm,晶胞体积V=(acm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子个数为4,立方氮化硼的密度=$\frac{\frac{4M}{{N}_{A}}}{V}$=$\frac{4×25}{NA×a{\;}^{3}}$g/cm3=$\frac{100}{{a}^{3}N{\;}_{A}}$g/cm3,
故答案为:$\frac{100}{{a}^{3}N{\;}_{A}}$;
④如图是立方氮化硼晶胞沿z轴的投影图,每个N原子被4个B原子共用、每个B原子被4个N原子共用,所以其图为 ,
,
故答案为: .
.
点评 本题考查物质结构和性质,为高频考点,侧重考查学生空间想象能力及计算能力,涉及晶胞计算、原子杂化方式判断、配位键及氢键、原子核外电子排布等知识点,注意采用三视图确定N原子和B原子位置关系,题目难度中等.

 阅读快车系列答案
阅读快车系列答案 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )| A. | 该物质中磷元素的化合价为+3 | |
| B. | 该物质分子中不含非极性共价键 | |
| C. | 该物质的熔、沸点比P4低 | |
| D. | 该物质22 g含硫原子的数目约为1.806×1023 |
| A. | 元素 | B. | 单质 | C. | 分子 | D. | 原子 |
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.
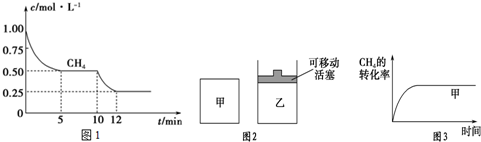
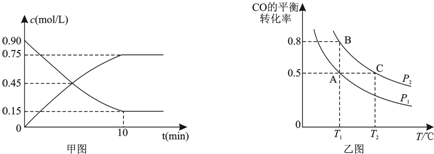
反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度.反应①平衡常数表达式为$\frac{c(CO)•c({H}_{2})^{3}}{c(C{H}_{4})•c({H}_{2}O)}$.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应③中△H3=-41.2kJ/mol.800℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v正>v逆 b.v正<v逆 c.v正=v逆 d.无法判断.
| A. | ${\;}_{94}^{238}$X与${\;}_{94}^{240}$Y互为同素异形体 | |
| B. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z互为同素异形体 | |
| C. | ${\;}_{94}^{240}$Y与${\;}_{92}^{238}$Z具有相同中子数 | |
| D. | ${\;}_{94}^{238}$X与${\;}_{92}^{238}$Z具有相同化学性质 |
| A. | 长期放置的苯酚晶体变红 | B. | 硝酸银晶体光照后变黑 | ||
| C. | 氢氧化亚铁变灰绿再变红褐 | D. | 二氧化碳气体冷却后变淡 |
| A. | 常温下,pH=4.3 的 CH3COOH与 CH3COONa 混合溶液中 tc(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4,溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCL)>KspCAg2CrCO4),则 AgCl的溶解度大于Ag2CrCO4 | |
| D. | 向冰醣酸加少就水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$增大 |