题目内容
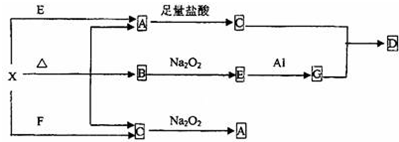
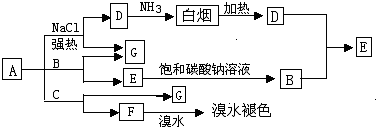
物质A~G间有如图所示的转化关系(有些产物没有列出),其中A、B、C都是酸式盐,焰色反应均呈紫色(透过钴玻璃),D、E和F都是酸性气体.据此回答下列问题:
(1)写出物质的化学式:A 、B 、C 、G ;
(2)写出下列反应的离子方程式:
①A与C的反应: ;
②F与溴水的反应: ;
③B和D的反应: .
(3)当生成等物质的量的D、E、F三种气体时,消耗的A的物质的量比为: ;
(4)用惰性电极电解G的水溶液,电极反应式为:
阳极: ,阴极: .

(1)写出物质的化学式:A
(2)写出下列反应的离子方程式:
①A与C的反应:
②F与溴水的反应:
③B和D的反应:
(3)当生成等物质的量的D、E、F三种气体时,消耗的A的物质的量比为:
(4)用惰性电极电解G的水溶液,电极反应式为:
阳极:
考点:无机物的推断
专题:推断题
分析:物质A、B、C都是酸式盐,焰色反应均呈紫色(透过钴玻璃),均含有K+,D、E和F都是酸性气体,D与氨气生成白烟,加热又可以得到D,则D为HCl,A与NaCl反应得到气体,与C反应生成使溴水褪色的气体,F具有还原性,则A为KHSO4,C为NaHSO3,B能与饱和碳酸钠反应生成B,而B又能与HCl反应生成B,则B为NaHCO3,G为Na2SO4,验证符合转化关系,据此解答.
解答:
解:物质A、B、C都是酸式盐,焰色反应均呈紫色(透过钴玻璃),均含有K+,D、E和F都是酸性气体,D与氨气生成白烟,加热又可以得到D,则D为HCl,A与NaCl反应得到气体,与C反应生成使溴水褪色的气体,F具有还原性,则A为KHSO4,C为NaHSO3,B能与饱和碳酸钠反应生成B,而B又能与HCl反应生成B,则B为NaHCO3,G为Na2SO4,验证符合转化关系,
(1)由上述分析可知,A为KHSO4,B为NaHCO3,C为NaHSO3,G为,故答案为:KHSO4;NaHCO3;NaHSO3;
(2)①A与C的反应离子方程式:H++HSO3-
SO2↑+H2O;
②F与溴水的反应离子方程式:SO2+Br2+2H2O=4H++SO42-+2Br-;
③B和D的反应离子方程式:H++HCO3-
CO2↑+H2O,
故答案为:H++HSO3-
SO2↑+H2O;SO2+Br2+2H2O=4H++SO42-+2Br-;H++HCO3-
CO2↑+H2O;
(3)生成HCl方程式为:2KHSO4+2NaCl
2HCl↑+Na2SO4+K2SO4,故生成1molHCl需要1mol KHSO4,生成二氧化硫为:H++HSO3-
SO2↑+H2O,故生成1molSO2需要1mol KHSO4,生成二氧化碳为:H++HCO3-
CO2↑+H2O,故生成1molSO2需要1mol KHSO4,故消耗KHSO4的物质的量比为1:1:1,
故答案为:1:1:1;
(4)用惰性电极电解Na2SO4的水溶液,阳极电极反应式为4OH--4e-=O2↑+2H2O,阴极电极反应式为4H++4e-=2H2↑,
故答案为:4OH--4e-=O2↑+2H2O;4H++4e-=2H2↑.
(1)由上述分析可知,A为KHSO4,B为NaHCO3,C为NaHSO3,G为,故答案为:KHSO4;NaHCO3;NaHSO3;
(2)①A与C的反应离子方程式:H++HSO3-
| ||
②F与溴水的反应离子方程式:SO2+Br2+2H2O=4H++SO42-+2Br-;
③B和D的反应离子方程式:H++HCO3-
| ||
故答案为:H++HSO3-
| ||
| ||
(3)生成HCl方程式为:2KHSO4+2NaCl
| ||
| ||
| ||
故答案为:1:1:1;
(4)用惰性电极电解Na2SO4的水溶液,阳极电极反应式为4OH--4e-=O2↑+2H2O,阴极电极反应式为4H++4e-=2H2↑,
故答案为:4OH--4e-=O2↑+2H2O;4H++4e-=2H2↑.
点评:本题考查无机物推断,关键是关键酸式盐与NaCl反应生成气体,这是实验室制备HCl的反应,再结合C可以使溴水褪色,注意(4)电极反应式书写中电子转移守恒,难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )
| R | ||
| X | Y | Z |
| A、X的氢化物比Z的氢化物稳定 |
| B、原子半径大小顺序是Z>Y>X |
| C、Y、R形成的化合物YR3能使酸性KMnO4溶液褪色 |
| D、X、Z可形成化合物XZ3,分子中各原子均满足最外层8电子的稳定结构 |

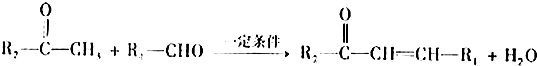

 .有机物X的键线式为:
.有机物X的键线式为: