题目内容
1.下列实验的解释或结论不正确的是( )| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中加入NaOH并微热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定存在NH4+ |
| B | 铜粉不能溶于冷的浓硫酸 | 铜在冷的浓硫酸中发生钝化 |
| C | 往溴水中通入SO2,溶液褪色 | SO2具有还原性 |
| D | 向FeCl2溶液中通入Cl2,溶液由浅绿色变为黄色 | Cl2的氧化性比FeCl3的强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.产生的能使湿润的红色石蕊试纸变蓝的气体为氨气,则原溶液中一定含有铵根离子;
B.铜化学性质不活泼,与冷的浓硫酸不发生反应;
C.二氧化硫具有还原性,能够被溴水氧化,该反应二氧化硫没有表现还原性;
D.亚铁离子被氯气氧化成铁离子,溶液由浅绿色变为黄色.
解答 解:A.向某溶液中加入NaOH并微热,产生能使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,则原溶液中一定存在NH4+,故A正确;
B.铜不与冷的浓硫酸反应,不是发生钝化现象,是由于铜的活泼性较差导致的,故B错误;
C.往溴水中通入SO2,溶液褪色,二氧化硫表现的是还原性,不是漂白性,故C正确;
D.向FeCl2溶液中通入Cl2,溶液由浅绿色变为黄色,说明亚铁离子被氯气氧化成铁离子,则Cl2的氧化性比FeCl3的强,故D正确;
故选B.
点评 本题考查了化学实验方案的设计与评价,题目难度中等,涉及二氧化硫的漂白性、氧化性强弱比较、金属的钝化、离子检验等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
1.研究小组为探究弱酸性条件下铁发生电化学腐类型的影响因素,将2.0g新制铁粉和0.5g碳粉混合均匀并置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
实验测得容器中压强随时间变化如图2,.则下列说法不正确的是( )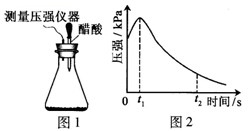
实验测得容器中压强随时间变化如图2,.则下列说法不正确的是( )

| A. | t2时容器中压强明显小于起始压强原因是铁发生了吸氧腐蚀 | |
| B. | 0~t2时压强变大的原因可能是铁发生了析氢腐蚀 | |
| C. | 0~t1时压强变大的原因可能是腐蚀过程为放热反应,锥形瓶内气体温度升高 | |
| D. | 钢铁在酸性条件下一定发生析氢腐蚀 |
9.下列五种烃:①正丁烷 ②异丁烷 ③丙烷 ④辛烷 ⑤乙烷,按它们的沸点由高到低的顺序排列为( )
| A. | ①④②③⑤ | B. | ④①②③⑤ | C. | ⑤③②①④ | D. | ④①③⑤② |
16.已知反应CaCO3(s)+2HCl(l)═CaCl2(aq)+H2O(l)+CO2(g)↑,下列措施中可使生成CO2的反应速率加快的是(不考虑CaCO3与HCl接触面积改变的影响)( )
| A. | 加大CaCO3的量 | B. | 加大盐酸的浓度 | ||
| C. | 及时将产生的CO2导出 | D. | 减小CaCl2的浓度 |
10.含有非极性键的共价化合物是( )
| A. | H2O2 | B. | CO2 | C. | Na2O2 | D. | F2 |
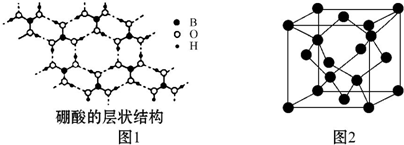

 ;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.
;④HCHO等,其中碳原子采取sp2杂化的分子有①③④(填序号);HCHO分子的空间构型为平面三角形.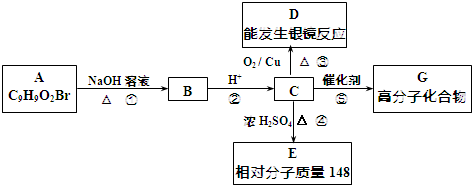
 .
.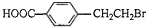 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.
+NaBr+H2O. .
.
 .
.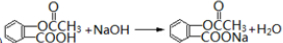 .
.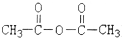 )反应制得.
)反应制得.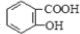 ;
;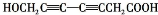 、
、 .
.