题目内容
13.芳香族化合物A只有两个对位取代基,在一定条件下有如图所示转化关系.其中,1molC与Na完全反应生成1molH2,1molC与NaHCO3完全反应,产生1mol气体,E能使溴的四氯化碳溶液褪色.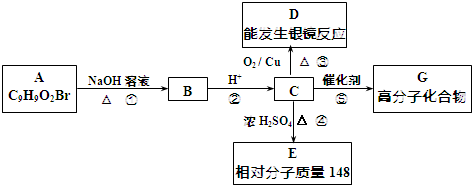
请回答下列问题:
(1)A的结构简式是
 .
.(2)E分子中的含氧官能团名称是碳碳双键、羧基.
(3)写出反应①的化学方程式
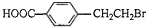 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O.
+NaBr+H2O.(4)写出反应⑤的化学方程式
 .
.(5)与C取代基位置相同,既能与FeCl3溶液显色.又能发生水解反应的同分异构体共有6种.
(6)现有C和E的混合物nmol,在空气中完全燃烧消耗O2224nL(标准状况),若生成CO2aL(标准状况)、H2Obg,则C、E混合物中含E的物质的量的计算式为($\frac{5a}{201.6}-\frac{b}{18}$)mol.
分析 1molC与Na完全反应生成1molH2,若1molC与NaHCO3完全反应,也产生1mol气体,说明C中含有1个-COOH和1个-OH,且位于对位位置,且C氧化产物能发生银镜反应,结合A的结构特点和分子式可知C应为 ,则A为
,则A为 ,B为
,B为 ,D为
,D为 ,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为
,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为 ,其相对分子质量为148,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物,结合有机物的结构和性质解答该题.
,其相对分子质量为148,C中含有-OH和-COOH,可发生缩聚反应生成高分子化合物,结合有机物的结构和性质解答该题.
解答 解:1molC与Na完全反应生成1molH2,若1molC与NaHCO3完全反应,也产生1mol气体,说明C中含有1个-COOH和1个-OH,且位于对位位置,且C氧化产物能发生银镜反应,结合A的结构特点和分子式可知C应为 ,则A为
,则A为 ,B为
,B为 ,D为
,D为 ,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为
,E可以使溴的四氯化碳溶液褪色,说明有碳碳双键,C在浓硫酸作用下发生消去反应生成E,应为 ,
,
(1)由以上分子可知,A的结构简式是 ,
,
故答案为: ;
;
(2)E为 ,E分子中的含氧官能团名称是碳碳双键、羧基,
,E分子中的含氧官能团名称是碳碳双键、羧基,
故答案为:碳碳双键、羧基;
(3)反应①为A的碱性水解以及羧基被中和,反应的化学方程式为: +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O,
+NaBr+H2O,
故答案为: +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$ +NaBr+H2O;
+NaBr+H2O;
(4)反应⑤为C发生缩聚反应生成高分子化合物,反应的方程式为 ,
,
故答案为: ;
;
(5)与C取代基位置相同,既能与FeCl3溶液显色,说明含有酚羟基,又能发生水解反应,说明含有酯基,对应的同分异构体有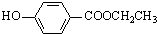 、
、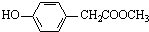 、
、 ,共6种,
,共6种,
故答案为:6;
(6)C为 ,E为
,E为 ,每摩尔
,每摩尔 消耗氧气10mol,每摩尔
消耗氧气10mol,每摩尔 消耗氧气10mol,所以C和E的混合物nmol,在空气中完全燃烧消耗O2为10nmol即224nL(标准状况),若生成CO2aL(标准状况)、H2Obg即$\frac{b}{18}$mol,设E的物质的量为xmol、C的物质的量为ymol,根据元素守恒有$\left\{\begin{array}{l}{9x+9y=\frac{a}{22.4}}\\{4x+5y=\frac{b}{18}}\end{array}\right.$,所以x=$\frac{\frac{5a}{22.4}-\frac{b}{2}}{9}$=$\frac{5a}{201.6}-\frac{b}{18}$,即E的物质的量的为($\frac{5a}{201.6}-\frac{b}{18}$)mol,
消耗氧气10mol,所以C和E的混合物nmol,在空气中完全燃烧消耗O2为10nmol即224nL(标准状况),若生成CO2aL(标准状况)、H2Obg即$\frac{b}{18}$mol,设E的物质的量为xmol、C的物质的量为ymol,根据元素守恒有$\left\{\begin{array}{l}{9x+9y=\frac{a}{22.4}}\\{4x+5y=\frac{b}{18}}\end{array}\right.$,所以x=$\frac{\frac{5a}{22.4}-\frac{b}{2}}{9}$=$\frac{5a}{201.6}-\frac{b}{18}$,即E的物质的量的为($\frac{5a}{201.6}-\frac{b}{18}$)mol,
故答案为:224n;($\frac{5a}{201.6}-\frac{b}{18}$)mol.
点评 本题考查有机物的推断,题目难度中等,本题注意根据根据题给信息,以C为推断该题的突破口,难点是同分异构体的判断,注意把握题给信息以及判断同分异构体的方法.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | Li和Na | B. | Rb和Ca | C. | Na和Cu | D. | K和Na |
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中加入NaOH并微热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定存在NH4+ |
| B | 铜粉不能溶于冷的浓硫酸 | 铜在冷的浓硫酸中发生钝化 |
| C | 往溴水中通入SO2,溶液褪色 | SO2具有还原性 |
| D | 向FeCl2溶液中通入Cl2,溶液由浅绿色变为黄色 | Cl2的氧化性比FeCl3的强 |
| A. | A | B. | B | C. | C | D. | D |
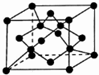 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化方式为sp杂化.
(4)G、Q、R氟化物的熔点如表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2>NaF,故MgF2的熔点比NaF高.
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)X单质的一种晶胞如图所示,一个X晶胞中有8个X原子;若该晶体的密度为ρ g/cm3,何伏加德罗常数的值为NA,则晶体中最近的两个X原子核之间的距离为$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{2sin\frac{109°28′}{2}}$(或$\frac{\sqrt{3}}{4}×\root{3}{\frac{96}{ρ{N}_{A}}}$)cm(用含ρ、NA代数式表示).
| A. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| B. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 硬脂酸甘油酯在碱性条件下的水解属于皂化反应,乙酸乙酯在碱性条件下的水解不属于皂化反应 |
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.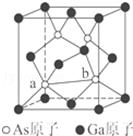 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题: 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示. .
. ⑦CH3CH2OH中与甲烷互为同系物的是①,分子空间构型为平面形的是④⑥,直线形的是⑤.
⑦CH3CH2OH中与甲烷互为同系物的是①,分子空间构型为平面形的是④⑥,直线形的是⑤.