题目内容
20.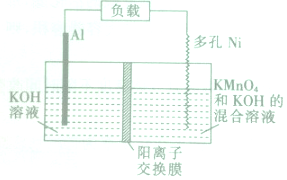 Licht等科学家设计的Al-MnO4-电池原理如图所示,电池总反应为Al+MnO4-═AlO2-+MnO2,下列说法正确的是( )
Licht等科学家设计的Al-MnO4-电池原理如图所示,电池总反应为Al+MnO4-═AlO2-+MnO2,下列说法正确的是( )| A. | 电池工作时,K+向负极区移动 | |
| B. | Al电极发生还原反应 | |
| C. | 正极的电极反应式为MnO4-+4H++3e-═MnO2+2H2O | |
| D. | 理论上电路中每通过1mol电子,负极质量减少9g |
分析 该电池的负极是Al,Ni是正极,在正极上发生得电子的还原反应,即MnO4-+2H2O+3e-═MnO2+4OH-,负极上金属铝失电子发生氧化反应,即Al+4OH-═Al(OH)4-,电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题.
解答 解:A.电池工作时,阳离子向正极移动,即K+向正极移动,故A错误;
B.反应中铝为被氧化,为负极,故B错误;
C.电解质呈碱性,MnO4-在正极上发生得电子的还原反应,即MnO4-+2H2O+3e-═MnO2+4OH-,故C错误;
D.理论上电路中每通过1mol电子,则有$\frac{1}{3}$mol铝被氧化,负极质量减少9g,故D正确.
故选D.
点评 本题考查化学电源新型电池,侧重于电极反应方程式的考查,题目难度中等,注意从正负极发生的变化结合电解质的特点书写电极反应式,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.化学与人类生活、生产和社会可持续发展密切相关.下列说法正确的是( )
| A. | 往自来水中加入明矾进行杀菌消毒 | |
| B. | 氮化硅陶瓷是一种新型的无机非金属材料 | |
| C. | 在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 为提高农作物的产量和质量,应大量使用化肥和农药 |
11.下列关于胶体的叙述正确的是( )
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,可制备氢氧化铁胶体 | |
| B. | 电泳现象可以证明胶体粒子带电 | |
| C. | 用石膏或盐卤点制豆腐,利用了胶体的吸水性 | |
| D. | 胶体粒子很小,可以透过滤纸和半透膜 |
8.人体中含量最高的微量元素是( )
| A. | 碘 | B. | 铁 | C. | 锌 | D. | 铜 |
5.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是( )
| A. | Na2CO3溶液显碱性:CO32-+2H2O═H2CO3+2OH- | |
| B. | HS-电离的离子方程式:HS-+H2O═H3O++S2- | |
| C. | 少量氢氧化钙溶液与碳酸氢钠溶液混合,反应的离子方程式:Ca2++2HCO3-+2OH-═CaCO3+2H2O+CO32- | |
| D. | 在0.5 mol•L-1的K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O═2CrO42-+2H+,其平衡常数的表达式为$\frac{{{c^2}(CrO_4^{2-})•{c^2}({H^+})}}{{c(C{r_2}O_7^{2-})}}$ |
12.下列关于反应与能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ/mol:E反应物<E生成物 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)△H=+178.2 kJ/mol:E反应物<E生成物 | |
| C. | HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3 kJ/mol:1 mol HCl在密闭容器中分解后放出92.3 kJ的热量 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol:含1 mol NaOH的烧碱溶液与含0.5 mol H2SO4的浓H2SO4混合后放出57.3 kJ的热量 |
9. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
 X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )| A. | Q位于第三周期IA族 | |
| B. | X、Y、Z三种元素组成的化合物可能是盐或碱 | |
| C. | 简单离子半径:M->Q+>R2+ | |
| D. | Z与M的最高价氧化物对应水化物均为强酸 |
10.对于pH相等的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 溶液浓度相等 | |
| B. | c(Cl-)=c(CH3COO-) | |
| C. | 等体积的两种酸,中和所需NaOH溶液的体积盐酸比醋酸多 | |
| D. | 分别加水稀释至原体积的10倍,盐酸的pH小于醋酸 |