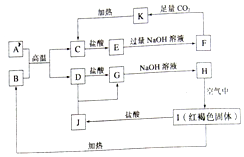
题目内容
9. X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示.下列说法错误的是( )| A. | Q位于第三周期IA族 | |
| B. | X、Y、Z三种元素组成的化合物可能是盐或碱 | |
| C. | 简单离子半径:M->Q+>R2+ | |
| D. | Z与M的最高价氧化物对应水化物均为强酸 |
分析 由原子半径和化合价可知X为H元素、Y为O元素、Z为N元素,M为Cl元素,Q为Na元素,R为Ca元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:X为H元素、Y为O元素、Z为N元素,M为Cl元素,Q为Na元素,R为Ca元素,
A.Q为Na元素,位于第三周期IA族,故A正确;
B.X、Y、Z三种元素组成的化合物可为NH3•H2O或NH4NO3,分别为碱、盐,故B正确;
C.R为Ca元素、Q为Na元素,对应的离子,Ca比Na多一个电子层,则Ca的离子半径较大,故C错误;
D.Z与M的最高价氧化物对应水化物分别为硝酸、高氯酸,均为强酸,故D正确.
故选C.
点评 本题考查结构性质与位置关系等,为高频考点,侧重考查学生的分析能力,难度不大,根据化合价与原子半径推断元素是解题的关键,注意对元素周期律的理解掌握.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
20.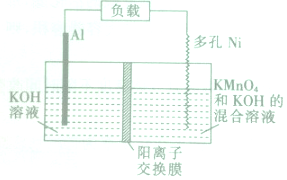 Licht等科学家设计的Al-MnO4-电池原理如图所示,电池总反应为Al+MnO4-═AlO2-+MnO2,下列说法正确的是( )
Licht等科学家设计的Al-MnO4-电池原理如图所示,电池总反应为Al+MnO4-═AlO2-+MnO2,下列说法正确的是( )
 Licht等科学家设计的Al-MnO4-电池原理如图所示,电池总反应为Al+MnO4-═AlO2-+MnO2,下列说法正确的是( )
Licht等科学家设计的Al-MnO4-电池原理如图所示,电池总反应为Al+MnO4-═AlO2-+MnO2,下列说法正确的是( )| A. | 电池工作时,K+向负极区移动 | |
| B. | Al电极发生还原反应 | |
| C. | 正极的电极反应式为MnO4-+4H++3e-═MnO2+2H2O | |
| D. | 理论上电路中每通过1mol电子,负极质量减少9g |
14.下列有关仪器的使用方法或实验操作正确的是( )
| A. | 盛装碱性试剂的试剂瓶应该使用橡皮塞 | |
| B. | 分离酒精和水可以采用分液法 | |
| C. | 蒸发结晶时应该将水分全部蒸干 | |
| D. | 在托盘天水左右托盘各放质量大小相同的纸,在左边纸上放氢氧化钠称量 |
1.以下实验方法及图象均正确的是( )
| A. | 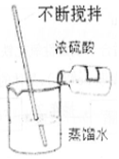 稀释浓硫酸 | B. | 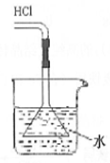 用水吸收氯化氢 | C. | 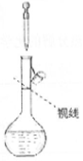 加水定容 | D. |  实验室制氨气 |
19.下列说法中有明显错误的是( )
| A. | 对有气体参加的化学反应,增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 有效碰撞一定在活化分子之间,活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
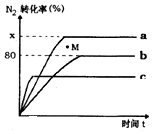 氢气是一种高能燃料,也广范应用在工业合成中.
氢气是一种高能燃料,也广范应用在工业合成中.