题目内容
如图1所示是用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+8H2O(l)△H<0.一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化,所用注射器的容积充裕):

(1)该实验探究的是 因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: < (填实验序号)
(2)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,② .
(3)若实验①在4min末收集了4.48mL CO2(标准状况),则4min末c(MnO4-)= mol?L-1(假设溶液混合后体积为50mL),此4min内的平均速率为v(H2C2O4)= .
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定 来比较化学反应速率.

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
(2)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②
(3)若实验①在4min末收集了4.48mL CO2(标准状况),则4min末c(MnO4-)=
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定
考点:探究影响化学反应速率的因素
专题:化学反应速率专题
分析:(1)对比①②实验可探究草酸浓度对化学反应速率的影响,②中A溶液的浓度比①中大;
(2)根据反应中除了催化剂影响反应速率外,还可能是反应过程中放出的热量导致反应速率加快;
(3)先求出反应的n(MnO4-)的物质的量,再求出反应后的浓度;根据v=
计算出4min内的平均速率为v(H2C2O4);
(4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
(2)根据反应中除了催化剂影响反应速率外,还可能是反应过程中放出的热量导致反应速率加快;
(3)先求出反应的n(MnO4-)的物质的量,再求出反应后的浓度;根据v=
| △c |
| △t |
(4)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
解答:
解:(1)对比①②实验可探究草酸的浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,
故答案为:草酸溶液的浓度;①;②;
(2)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,有可能为:②该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
故答案为:反应放出的热量使环境温度升高,加速反应;
(3)CO2的物质的量为:
=0.0002mol,设2min末,反应消耗的n(MnO4-)为x,
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.0002mol
解得 x=0.00004mol
反应剩余的高锰酸根离子的物质的量为:30×10-3L×0.01mol?L-1-0.00004mol=0.00026mol
c(MnO4-)=
=
=5.2×10-3mol/L;
4min内的平均速率为v(H2C2O4)=
=
=5×10-4mol/(L?min),
故答案为:5.2×10-3;5×10-4mol/(L?min);
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,
故答案为:KMnO4溶液完全褪色所需时间(或产生相同体积气体所需的时间).
故答案为:草酸溶液的浓度;①;②;
(2)研究发现反应速率总是如图2所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,有可能为:②该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
故答案为:反应放出的热量使环境温度升高,加速反应;
(3)CO2的物质的量为:
| 4.48×10-3L |
| 22.4L/mol |
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.0002mol
解得 x=0.00004mol
反应剩余的高锰酸根离子的物质的量为:30×10-3L×0.01mol?L-1-0.00004mol=0.00026mol
c(MnO4-)=
| n |
| V |
| 0.00026mol |
| 0.05L |
4min内的平均速率为v(H2C2O4)=
| △c |
| △t |
| ||
| 4min |
故答案为:5.2×10-3;5×10-4mol/(L?min);
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,
故答案为:KMnO4溶液完全褪色所需时间(或产生相同体积气体所需的时间).
点评:本题考查了影响化学反应速率的因素,难度中等,注意掌握影响化学反应速率的因素,明确探究影响化学反应速率因素的方法.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:

下列有关三聚氰酸的说法正确的是( )

下列有关三聚氰酸的说法正确的是( )
| A、分子式为C3H6N303 |
| B、分子中既含极性键,又含非极性键 |
| C、属于共价化合物 |
| D、生成该物质的上述反应为中和反应 |
“在3支大小相同的试管中各加入2mL 5%的H2O2溶液,再向其中2支试管中分别加入少量MnO2粉末、2滴1mol/LFeCl3溶液.对比观察现象.”该实验的目的是( )
| A、探究浓度对反应速率的影响 |
| B、探究温度对反应速率的影响 |
| C、探究固体表面积对反应速率的影响 |
| D、探究催化剂对反应速率的影响 |
 如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )
如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )| A、R的气态氢化物与它的含氧酸之间能发生化学反应 |
| B、原子半径大小顺序是:Z>Y>X |
| C、Y、Z的单质在一定条件下均能与Fe反应 |
| D、X、Y、Z中Z的氧化物对应的水化物的酸性最强 |
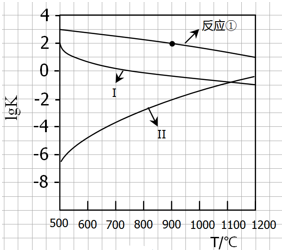 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.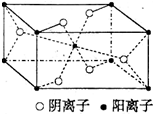 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.