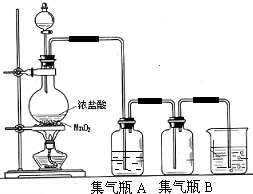
题目内容
4.除去铁粉中少量铝粉,可选用的试剂是( )| A. | 稀HCl | B. | 稀H2SO4 | C. | NaOH溶液 | D. | NaCl溶液 |
分析 铝既可与酸反应,也可与强碱反应,根据二者性质的异同选择分离方法,以此解答.
解答 解:铁粉和铝粉都是活泼金属,都能和酸反应和弱碱不反应;但铝粉和铁粉的不同化学性质是:铝粉能和强碱反应生成盐和氢气,而铁粉和强碱不反应,则可用氢氧化钠溶液除杂,
故选C.
点评 本题考查物质的分离、提纯,为高考常见题型,除杂时要注意不能引入新的杂质,更不能影响被提纯的物质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列各组离子中,能在水溶液中大量共存,且溶液显酸性的是( )
①Na+、H+、SO42-、HCO3-
②K+、Al3+、H2PO4-、HCO3-
③Na+、H+、Cl-、C6H5O-
④H+、Fe2+、NO3-、Cl-
⑤Na+、Al3+、NO3-、AlO2-
⑥Cu2+、Mg2+、SO42-、NO3-.
①Na+、H+、SO42-、HCO3-
②K+、Al3+、H2PO4-、HCO3-
③Na+、H+、Cl-、C6H5O-
④H+、Fe2+、NO3-、Cl-
⑤Na+、Al3+、NO3-、AlO2-
⑥Cu2+、Mg2+、SO42-、NO3-.
| A. | ②③⑤ | B. | ①⑥ | C. | ①④⑤ | D. | 只有⑥ |
12.下列关于物质物分类的说法正确的组合是( )
①非金属氧化物一定是酸性氧化物
②金属氧化物不一定是碱性氧化物
③碱性氧化物一定是金属氧化物
④Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物
⑤纯净物是由一种元素组成,而混合物由两种或两种以上元素组成
⑥只由一种元素的阳离子与另一种元素的阴离子组成的物质一定为纯净物.
①非金属氧化物一定是酸性氧化物
②金属氧化物不一定是碱性氧化物
③碱性氧化物一定是金属氧化物
④Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物
⑤纯净物是由一种元素组成,而混合物由两种或两种以上元素组成
⑥只由一种元素的阳离子与另一种元素的阴离子组成的物质一定为纯净物.
| A. | ①④⑤⑥ | B. | ②③ | C. | ③④⑥ | D. | ②③⑥ |
19.某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )
| A. | Cl- NO3- Ba2+ Fe3+ | B. | SO42- S2- Al3+ Mg2+ | ||
| C. | Na+ K+ SO42- Cl- | D. | NH4+ Ba2+ Cl- HCO3- |
16.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
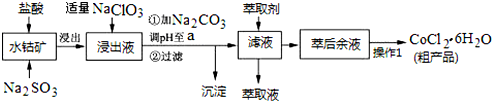
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
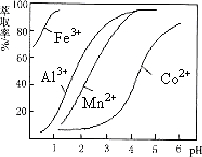
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
13.相同温度、相同浓度的下列电解质溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别是( )
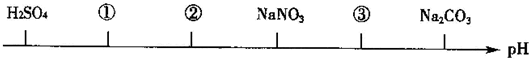
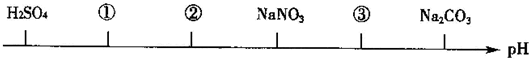
| A. | CuCl2 CH3COOH NaOH | B. | HCl H2SO3 NaHCO3 | ||
| C. | HF HCl CH3COONa | D. | NH4Cl HCl CH3COONa |
14.下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终一定能得到纯净物的是( )
| A. | 向FeSO4溶液中通入过量Cl2 | |
| B. | 向NaHCO3溶液中加入一定质量的Na2O2粉末 | |
| C. | 向NaI和NaBr混合溶液中通入过量Cl2 | |
| D. | 向NaOH溶液中加入过量AlCl3(SO4)3 |