题目内容
2.两种有机物A和B可以互溶,有关性质如下:| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
| B | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
a.重结晶 b.蒸馏 c.萃取 d.加水充分振荡,分液
(2)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的最简式为C2H6O,若要确定其分子式,是否必需有其它条件否(填“是”或“否”). 已知有机物A的质谱、核磁共振氢谱如图1所示,则A的结构简式为CH3CH2OH.

(3)若质谱图2显示B的相对分子质量为74,红外光谱如图3所示,则B的结构简式为CH3CH2OCH2CH3,其官能团的名称为醚键.
(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重19.8g和35.2g.计算混合物中A和B的物质的量之比2:1.
分析 (1)互溶的液体采用蒸馏方法分离;
(2)根据元素守恒可判断有机化合物中一定含有C和H两种元素,根据生成8.8g的二氧化碳中C元素质量即为化合物中所含C元素质量、生成5.4g 的水中H元素质量即为化合物中所含H元素质量,对氧元素的确定要根据二氧化碳和水中的氧元素质量之和与氧气中氧元素的质量来分析,若前者大,则有机化合物有氧元素,两者相等,则有机化合物没有有氧元素,然后求出各自的物质的量,根据各元素的物质的量之比可推测最简式,根据具体C原子、H原子、O原子个数比判断;根据核磁共振氢谱表明其分子中有三种化学环境不同的氢原子来确定结构简式;
(3)质谱图显示B的相对分子质量为74,含醚键和两个对称甲基,应为乙醚;
(4)产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重19.8g和35.2g,n(H2O)=$\frac{19.8g}{18g/mol}$=1.1mol,n(CO2)=$\frac{35.2g}{44g/mol}$=0.8mol,设CH3CH2OH、CH3CH2OCH2CH3的物质的量为x、y,结合原子守恒计算;
解答 解:(1)由表格中的信息可知,A、B两种有机物互溶,但沸点不同,则选择蒸馏法分离;
故答案为:B;
(2)根据质量守恒定律可知,化合物中所含C元素质量为:8.8g×$\frac{12}{44}$=2.4g,所含H元素质量为:5.4g×$\frac{2}{18}$=0.6g,二氧化碳和水中的氧元素质量之和为 (8.8g-2.4g)+(5.4g-0.6g)=11.2g,而氧气的质量为$\frac{6.72L}{22.4L/mol}$×32g/mol=9.6g,所以有机物中氧元素质量为11.2g-9.6g=1.6g,n(C):n(H):n(O)=$\frac{2.4}{12}$:$\frac{0.6}{1}$:$\frac{1.6}{16}$=2:6:1,所以化合物的最简式是C2H6O,在最简式C2H6O中,C、H原子已经达到饱和,其实验式即为分子式;分子式为C2H6O,甲醚中只含一种H,由核磁共振氢谱表明其分子中有三种化学环境不同的氢原子,强度之比为3:2:1,为乙醇结构简式为CH3CH2OH;
故答案为:C2H6O;否;CH3CH2OH;
(3)该有机物的相对原子质量为74,由红外光谱图显示存在对称的甲基、对称的亚甲基和醚键可得分子的结构简式为:CH3CH2OCH2CH3,其官能团的名称为醚键;
故答案为:CH3CH2OCH2CH3;醚键;
(4)产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重19.8g和35.2g,n(H2O)=$\frac{19.8g}{18g/mol}$=1.1mol,n(CO2)=$\frac{35.2g}{44g/mol}$=0.8mol,设CH3CH2OH、CH3CH2OCH2CH3的物质的量为x、y,则$\left\{\begin{array}{l}{2x+4y=0.8}\\{6x+10y=1.1×2}\end{array}\right.$
,解得x=0.2mol,y=0.1mol,则A和B的物质的量之比2:1;
故答案为:2:1;
点评 本题考查混合物分离提纯及有机物分子式确定,把握有机物的性质、结构确定方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案①金属钠投入到FeCl3溶液 ②过量Ba(OH)2溶液和明矾溶液
③Ba(HCO3)2溶液和NaHSO4溶液 ④Na2O2投入FeCl3溶液( )
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ①②③④ |
| A. | 加热浓氨水 | B. | 加热NH4Cl固体 | ||
| C. | 加热NH4Cl和Ca(OH)2的混合物 | D. | 加热小苏打固体 |
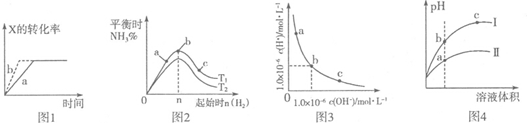
| A. | 图l所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | 图2表示合成氨反应,温度T1和T2对应的平衡常数为K1、K2,则:T1<T2,K1>K2 | |
| C. | 图3表明,该温度下,加入FeCl3不可能引起由b向a的变化 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
| A. | 钠与水的反应:2Na+2H+═2Na++H2↑ | |
| B. | 氯化铝溶液加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ | |
| D. | 少量SO2通入NaOH溶液:SO2+2OH-═SO32-+H2O |
| A. | 糖类的分子通式为 Cm(H2O)n | B. | 糖类物质都有甜味 | ||
| C. | 蔗糖不是淀粉水解的产物 | D. | 糖类一般都能水解反应 |
| A. | 向能使pH试纸显深蓝色的溶液中通入少量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向NaClO溶液中加入浓氢溴酸:ClO-+2H++2 Br-═Cl-+Br2+H2O | |
| C. | 向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向FeBr2溶液中滴加少量Cl2溶液:2 Br-+Cl2═Br2+2Cl- |
 在50mL过氧化氢溶液中加入0.1mol MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示.
在50mL过氧化氢溶液中加入0.1mol MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示.