题目内容
17. 在50mL过氧化氢溶液中加入0.1mol MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示.
在50mL过氧化氢溶液中加入0.1mol MnO2粉末,标准状况下放出气体的体积和时间的关系如图所示.(1)实验时放出气体的总体积是60mL.
(2)放出一半气体所需的时间为1min.
(3)A、B、C、D各点反应速率快到慢的顺序为D>C>B>A.
解释反应速率变化的原因随反应进行c(H2O2)减小,反应物浓度减小,减慢反应速率.
(4)求0~2min时O2的平均反应速率22.5mL•min-1.
分析 (1)反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)根据浓度对反应速率的影响判断A、B、C、D各点反应速率大小;
(4)0~2min时O2的平均反应速率等于$\frac{V}{t}$.
解答 解:(1)由反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,
故答案为:60mL;
(2)由图象可知,当时间进行到1min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为1min,
故答案为:1min;
(3)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A;随反应进行c(H2O2)减小,反应物浓度减小,减慢反应速率;
(4)0~2min时O2的平均反应速率等于$\frac{V}{t}$=$\frac{45ml}{2min}$=22.5mL•min-1,故答案为:22.5.
点评 本题考查过氧化氢分解的速率曲线,题目难度不大,主要考查浓度对反应速率的影响,正确分析图象的曲线变化是解答本题的关键.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
7.下列说法正确的是( )
| A. | 活化分子间所发生的碰撞为有效碰撞 | |
| B. | 由C(s,石墨)=C(s,金刚石)△H>0可知,金刚石比石墨稳定 | |
| C. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | 有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
5.有两种气态烷烃的混合物,在标准状况下,其密度为1.16g/L,则关于此混合物组成的说法正确的是( )
| A. | 一定是甲烷与乙烷的混合物 | B. | 可能是甲烷与丙烷的混合物 | ||
| C. | 一定含有乙烷 | D. | 可能是甲烷与己烷的混合物 |
12.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4L水含有NA个水分子 | |
| B. | 氧气和臭氧的混合物32 g中含有NA个氧原子 | |
| C. | 0.1mol Na2O2与水反应时转移0.1NA个电子 | |
| D. | 11.2 L氯气中含有NA个氯原子 |
2.两种有机物A和B可以互溶,有关性质如下:
(1)若要除去A和B的混合物中少量的B,可采用B(填代号)方法即可得到A.
a.重结晶 b.蒸馏 c.萃取 d.加水充分振荡,分液
(2)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的最简式为C2H6O,若要确定其分子式,是否必需有其它条件否(填“是”或“否”). 已知有机物A的质谱、核磁共振氢谱如图1所示,则A的结构简式为CH3CH2OH.

(3)若质谱图2显示B的相对分子质量为74,红外光谱如图3所示,则B的结构简式为CH3CH2OCH2CH3,其官能团的名称为醚键.
(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重19.8g和35.2g.计算混合物中A和B的物质的量之比2:1.
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |
| B | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
a.重结晶 b.蒸馏 c.萃取 d.加水充分振荡,分液
(2)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的最简式为C2H6O,若要确定其分子式,是否必需有其它条件否(填“是”或“否”). 已知有机物A的质谱、核磁共振氢谱如图1所示,则A的结构简式为CH3CH2OH.

(3)若质谱图2显示B的相对分子质量为74,红外光谱如图3所示,则B的结构简式为CH3CH2OCH2CH3,其官能团的名称为醚键.
(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重19.8g和35.2g.计算混合物中A和B的物质的量之比2:1.
9.下列关于氨气的说法正确的是( )
| A. | 氨气既能用浓硫酸干燥也能用无水CaCl2干燥 | |
| B. | NH3是电解质,所以氨水能导电 | |
| C. | 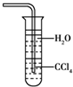 用水吸收NH3用如图装置可防止倒吸 | |
| D. | NH3可以使干燥的红色石蕊试纸变蓝 |
6.下列说法错误的是( )
| A. | 从1L1mol•L-1的NaCl溶液中取出10mL,其浓度仍为1mol•L-1 | |
| B. | 配制0.5L1mol•L-1的盐酸,需要氯化氢气体11.2L(标准状况) | |
| C. | 将40gNaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L | |
| D. | 0.5L2mol•L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
7.2015年12月12日,《联合国气候变化框架公约》近200个缔约方一致同意通过《巴黎协定》.指出各国应提高力度、加强国际合作,实现全球应对气候变化长期目标.下列做法与社会可持续发展理念相违背的是( )
| A. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| B. | 开发利用可再生能源,减少化石燃料的使用 | |
| C. | 研发可降解高分子材料,减少“白色污染冶 | |
| D. | 过度开采矿物资源,促进地方经济发展 |