题目内容
14.按要求回答下列问题:(1)写出甲苯与硝酸发生硝化反应的化学方程式:
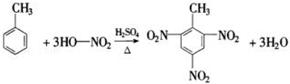 .
.(2)有机物
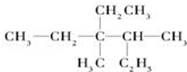 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷(3)某烃的结构简式是
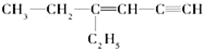 ,其中在同一平面上的碳原子至少为6个.
,其中在同一平面上的碳原子至少为6个.(4)苯环上有两个取代基的某烃C9H12的同分异构体有3种,其苯环上的一氯代物的同分异构体可能有10种,该烃被酸性高锰酸钾溶液氧化后可能形成的产物有多种,写出其中一种的结构简式:
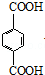 .
.
分析 (1)甲苯和硝酸反应发生取代反应,甲苯中的邻对位氢原子被硝基取代,据此书写化学方程式;
(2)物质为烷烃,选取最长碳链为主碳链,离取代基近的一端编号确定取代基位置,写出名称;
(3)根据连接四个基团(或原子)的碳原子为饱和碳原子,在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,注意单键可以旋转;
(4)分子组成为C9H12的苯的同系物,已知苯环上有2个取代基可能为甲基和乙基.
解答 解:(1)甲苯和硝酸反应发生取代反应,甲苯中的邻对位氢原子被硝基取代,据此书写化学方程式为: ,
,
故答案为: ;
;
(2)有机物 ,选取最长碳链为主碳链,含6个碳原子,3,4号碳上含有甲基,3号碳上有乙基,离取代基近的一端编号确定取代基位置,写出名称用系统命名法命名得到:3,4-二甲基-3-乙基己烷,
,选取最长碳链为主碳链,含6个碳原子,3,4号碳上含有甲基,3号碳上有乙基,离取代基近的一端编号确定取代基位置,写出名称用系统命名法命名得到:3,4-二甲基-3-乙基己烷,
故答案为:3,4-二甲基-3-乙基己烷;
(3)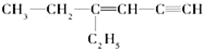 ,连接四个基团(或原子)的碳原子为分子中乙基中的碳原子,分子中有2个乙基,故分子中饱和碳原子数为4;分子中存在C≡C的直线结构,与C≡C相连的C=C中的碳原子处于乙炔的H原子位置,分子中存在C=C的平面型结构,与C=C直接相连的碳原子都在同一平面上,同时C=C中的1个碳原子与C≡C上的2个碳原子共线,所以最多在同一平面上的碳原子数为8,其中在同一平面上的碳原子至少为6个,
,连接四个基团(或原子)的碳原子为分子中乙基中的碳原子,分子中有2个乙基,故分子中饱和碳原子数为4;分子中存在C≡C的直线结构,与C≡C相连的C=C中的碳原子处于乙炔的H原子位置,分子中存在C=C的平面型结构,与C=C直接相连的碳原子都在同一平面上,同时C=C中的1个碳原子与C≡C上的2个碳原子共线,所以最多在同一平面上的碳原子数为8,其中在同一平面上的碳原子至少为6个,
故答案为:6;
(4)分子组成为C9H12的苯的同系物,已知苯环上有2个取代基可能为甲基和乙基,有邻间对3种同分异构体, 、
、 ,其苯环上的一氯代物分别有4种、4种、2种,故总共有10种,该烃被酸性高锰酸钾溶液氧化后可能形成的产物有多种,和苯环直接相连的碳原子上有氢原子,可以被氧化为羧基,如对甲乙基苯被氧化为对苯二甲酸,结构简式为:
,其苯环上的一氯代物分别有4种、4种、2种,故总共有10种,该烃被酸性高锰酸钾溶液氧化后可能形成的产物有多种,和苯环直接相连的碳原子上有氢原子,可以被氧化为羧基,如对甲乙基苯被氧化为对苯二甲酸,结构简式为: ,
,
故答案为:3;10; .
.
点评 本题考查了有机物结构与性质,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握有机物命名原则及同分异构体的书写原则,试题培养了学生灵活应用基础知识的能力.

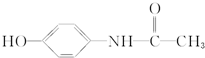 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 该有机物属于α-氨基酸 | |
| C. | 该有机物属于α-氨基酸的同分异构体有3种 | |
| D. | 该有机物与FeCl3溶液发生显色反应 |
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发.
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
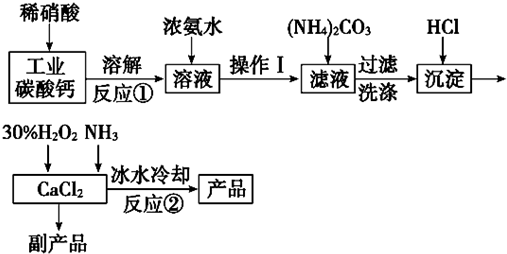
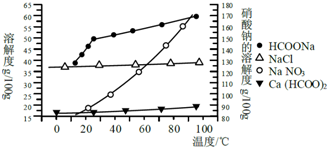
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤3.用石灰水调整溶液pH=5;
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH7~8;充分搅拌,所得溶液经蒸发结晶、趁热过滤、洗涤干燥得甲酸钙晶体;
(提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水)
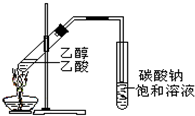 在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题: 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷. 2-甲基丁烷.
2-甲基丁烷. 中含氧官能团的名称为羟基、羧基、酯基.
中含氧官能团的名称为羟基、羧基、酯基.