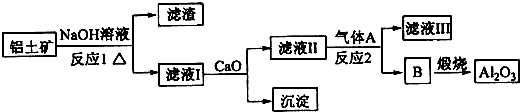
题目内容
10.等浓度的NH3•H2O和NH4Cl混合,电离大于(大于、小于、等于)水解,显碱性,等浓度的CH3COOH和CH3COONa混合,电离大于(大于、小于、等于)水解,显酸性.分析 相同浓度的一水合氨的电离程度大于铵根离子的水解程度,相同浓度的醋酸的电离程度大于醋酸根离子的水解程度,据此分析.
解答 解:相同浓度的一水合氨的电离程度大于铵根离子的水解程度,相同浓度的醋酸的电离程度大于醋酸根离子的水解程度,所以相同浓度的NH3•H2O和NH4Cl溶液显碱性,等浓度的CH3COOH和CH3COONa溶液显酸性,故答案为:大于;碱;大于;酸.
点评 本题考查了弱电解质的电离和弱电解质离子的水解,根据越弱越水解原理分析即可,题目难度不大.

练习册系列答案
相关题目
5.下列各组原子中,彼此化学性质一定相似的是( )
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 2p轨道上只有一个成单电子的X原子与3p轨道上只有一个成单电子的Y原子 | |
| C. | 2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子 | |
| D. | 最外层都只有1个电子的X、Y原子 |
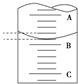 某工厂废水中含游离态氯,通过下列实验测定其浓度.
某工厂废水中含游离态氯,通过下列实验测定其浓度.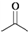 ,则
,则 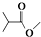 分子式:C5H8O2.
分子式:C5H8O2. .
. .
.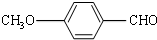 有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是:
有多种同分异构体,其中属于芳香族羧酸的同分异构体共有4种,它们的结构简式是: 、
、 ;
; ,
, (任意两种)(任写其中二种).
(任意两种)(任写其中二种). .
.