题目内容
1. 某工厂废水中含游离态氯,通过下列实验测定其浓度.
某工厂废水中含游离态氯,通过下列实验测定其浓度.①取水样10.00mL于锥形瓶中,加入10.00mL KI溶液(足量),滴入指示剂2~3滴.
②取一只碱式滴定管依次用自来水、蒸馏水洗净,然后注入0.010mol•L-1 Na2S2O3溶液,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3═2NaI+Na2S4O6.试回答下列问题:
(1)步骤①加入的指示剂是淀粉溶液.
(2)滴定时,眼睛应注视锥形瓶中溶液的颜色变化,判断到达滴定终点的现象是:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色,若耗去Na2S2O3溶液20.00mL,则废水中Cl2的物质的量浓度为0.01mol•L-1.
(3)实验中,Cl2的实际浓度比所测浓度偏小,造成误差的原因是:步骤②中碱式滴定管未用待测液润洗.
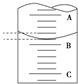
(4)如图表示50.00mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25.00mL,滴定管中液面读数应为25.40mL,设此时液体体积读数为a mL,滴定管中液体的体积V>(50-a) mL(填“=”、“>”或“<”).
(5)滴定结束时俯视刻度线读取滴定终点时Na2S2O3溶液的体积,会导致测定结果偏小(填“偏大”、“偏小”或“无影响”).
分析 (1)碘遇淀粉溶液变蓝色,当完全反应时,溶液褪色;
(2)滴定时,眼睛应注视锥形瓶中溶液颜色变化,溶液开始呈蓝色,随反应I2+2Na2S2O3=2NaI+2Na2S4O6进行,溶液中没有碘,溶液由蓝色为无色;结合化学方程式定量关系计算得到;
(3)根据碱式滴定管未用Na2S2O3溶液润洗,使得Na2S2O3溶液浓度偏小;
(4)A与C刻度间相差1mL,说明每两个小格之间是0.1mL,A处的刻度为25.00mL,据此确定B的刻度,注意滴定管的上面数值小,下面数值大,滴定管活塞下方或橡皮管无刻度;
(5)滴定结束时俯视刻度线使Na2S2O3溶液的体积偏小.
解答 解:(1)游离态的氯将碘离子氧化成单质碘,溶液中有单质碘,加入淀粉溶液呈蓝色,碘与亚硫酸钠发生氧化还原反应,当反应终点时,蓝色褪去,故答案为:淀粉溶液;
(2)滴定时,眼睛应注视锥形瓶中溶液颜色变化,碘遇淀粉变蓝色,溶液开始呈蓝色,随反应I2+2Na2S2O3=2NaI+2Na2S4O6进行,溶液中没有碘,溶液由蓝色为无色,说明反应到终点,判断达到滴定终点的实验现象是:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;根据反应可得:
Cl2+2I-=2Cl-+I2,I2+2Na2S2O3=2NaI+Na2S4O6
Cl2~2Na2S2O3
1 2
n 0.01mol•L-1×0.0200L
n=0.0001mol
c(Cl2)=$\frac{0.0001mol}{0.0100L}$=0.01mol/L,
故答案为:锥形瓶中溶液的颜色变化;滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;0.01mol/L;
(3)实验中,Cl2的实际浓度比所测浓度偏小,造成误差的原因是步骤②中碱式滴定管未用待测液润洗,使Na2S2O3溶液浓度变小,滴定时消耗Na2S2O3溶液的体积增大,测得的氯气含量偏大,实际浓度比所测浓度小,
故答案为:步骤②中碱式滴定管未用待测液润洗;
(4)A与C刻度间相差1mL,说明每两个小格之间是0.10mL,A处的刻度为25.00mL,A和B之间是四个小格,所以相差0.40mL,则B是25.40mL;滴定管刻度值从上到下刻度逐渐增大,由于滴定管活塞下方或橡皮管无刻度,50mL滴定管中实际盛放液体的体积大于50mL,如果液面处的读数是a,则滴定管中液体的体积大于(50-a)mL,
故答案为:25.40;>;
(5)滴定结束时俯视刻度线使Na2S2O3溶液的体积偏小,测得I2的物质的量偏小,则游离态氯的浓度偏小,
故答案为:偏小.
点评 本题考查了探究物质的组成及含量的测定,涉及氧化还原滴定、滴定误差分析,注意掌握氧化还原滴定的原理和方法是解题的关键,题目难度中.

| A. | 向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+ | |
| B. | 用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 | |
| C. | 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+ | |
| D. | 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
 ,试推断它不应具有的性质( )
,试推断它不应具有的性质( )| A. | 与NaOH溶液反应 | B. | 与金属钠反应 | ||
| C. | 与乙酸发生酯化反应 | D. | 一定条件下发生水解反应 |
| A. | 溶解、过滤、加热(升华)、蒸发(结晶) | B. | 加热(升华)、溶解、过滤、蒸发(结晶) | ||
| C. | 加热(升华)、溶解、蒸馏、结晶 | D. | 溶解、结晶、过滤、加热(升华) |
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 向盛l mL lmol•L-1AlCl3溶液的试管中加入3 mL10%NaF溶液,再加入l mL 3mol•L-1氨水,没有生成白色沉淀,其最主要的原因是氨水的浓度不够大,溶液的碱性不够 |
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加铜片和浓硫酸加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| (2)取少量该溶液,加BaCl2溶液 | 有白色沉淀产生 |
| (3)取(2)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于硝酸 |
| (4)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀溶解 |
| A. | 一定含有NO3-、SO42-和Cl- | |
| B. | 一定含有Al3+,可能含有Ba2+ | |
| C. | 一定含有NO3-、SO42-,可能含有HCO3- | |
| D. | 一定不含Fe2+、Ba2+和HCO3- |
 如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:
如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:N2(g)+3H2(g)?2NH3(g)△H=-192kJ•mol-1.向 M、N 中,都通入 xmol N2 和ymol H2的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
| A. | 若x:y=1;2,则平衡时,M中的转化率:N2>H2 | |
| B. | 若x:y=1:3,当M中放出热量172.8kJ时,N2的转化率为90% | |
| C. | 若x=1,y=3,则达到平衡时反应物的转化率N>M | |
| D. | 平衡时N2气体在两容器中体积分数可能相等 |


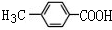 .
.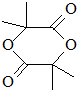 .
.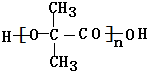 +(n-1)H2O,该反应属于缩聚反应(填反应类型).
+(n-1)H2O,该反应属于缩聚反应(填反应类型).