题目内容
已知钙的金属活泼性介于钾和钠之间,其化学性质与钠相似.钙及其化合物的有关反应如下:
①Ca+2H2O═Ca(OH)2+H2↑
②CaO+H2O═Ca(OH)2
③CaO2+H2O═
④CaO+CO2═CaCO3
⑤2CaO2+2CO2═2CaCO3+O2
结合所学知识完成下列问题:
(1)完成上述③的化学方程式:CaO2+H2O═ ;
(2)用双线桥标出反应①的电子转移方向和数目:Ca+2H2O═Ca(OH)2+H2↑
(3)写出以钙为原料制取过氧化钙(CaO2)的化学方程式: ;
(4)在CaO2的水溶液中,滴入酚酞溶液,预期的实验现象可能是 ;在该溶液中加入少量的MnO2固体,有气泡生成,写出该反应的化学方程式 .
①Ca+2H2O═Ca(OH)2+H2↑
②CaO+H2O═Ca(OH)2
③CaO2+H2O═
④CaO+CO2═CaCO3
⑤2CaO2+2CO2═2CaCO3+O2
结合所学知识完成下列问题:
(1)完成上述③的化学方程式:CaO2+H2O═
(2)用双线桥标出反应①的电子转移方向和数目:Ca+2H2O═Ca(OH)2+H2↑
(3)写出以钙为原料制取过氧化钙(CaO2)的化学方程式:
(4)在CaO2的水溶液中,滴入酚酞溶液,预期的实验现象可能是
考点:化学基本反应类型,氧化还原反应
专题:
分析:(1)钙的化学性质与钠相似,结合Na2O2与水的反应来分析;
(2)在反应中,钙元素的价态由0变为+2价,水的氢元素的价态由+1价变为0价,据此分析.
(3)根据钙与钠的性质的相似性来分析,仿照利用钠来制取过氧化钠的反应条件来书写;
(4)利用CaO2与Na2O2的性质的相似性来分析.
(2)在反应中,钙元素的价态由0变为+2价,水的氢元素的价态由+1价变为0价,据此分析.
(3)根据钙与钠的性质的相似性来分析,仿照利用钠来制取过氧化钠的反应条件来书写;
(4)利用CaO2与Na2O2的性质的相似性来分析.
解答:
解:(1)CaO2与Na2O2的性质的有很强的相似性,Na2O2与水的反应生成NaOH和O2,故CaO2和H2O反应生成Ca(OH)2和O2,故反应为CaO2+H2O═2Ca(OH)2+O2↑,
故答案为:2Ca(OH)2+O2↑;
(2)在反应中,钙元素的价态由0变为+2价,1molCa失去2mol电子;水的氢元素的价态由+1价变为0价,2molH2O得2mol电子,故电子转移的方向和数目为: ,故答案为:
,故答案为: ;
;
(3)钙与钠的性质具有很强的相似性,用钠来制取过氧化钠的反应条件是加热,故以钙为原料制取过氧化钙(CaO2)也是将钙放在空气中加热即可,故反应为:
Ca+O2
CaO2,故答案为:Ca+O2
CaO2;
(4)Na2O2与水反应时,先发生复分解反应生成H2O2和NaOH,然后H2O2分解生成氧气,故在Na2O2与水反应时即体现碱性也体现漂白性;而CaO2与Na2O2的性质有相似性,故在CaO2的水溶液中,也会先生成Ca(OH)2和H2O2,体现碱性也体现漂白性,故滴入酚酞溶液,预期的实验现象可能是溶液先变红色,后褪色;MnO2是H2O2分解的催化剂,故加入少量的MnO2固体,会促进双氧水的分解,有气泡生成,反应为:2H2O2
2H2O+O2↑,故答案为:溶液先变红色,后褪色;2H2O2
2H2O+O2↑.
故答案为:2Ca(OH)2+O2↑;
(2)在反应中,钙元素的价态由0变为+2价,1molCa失去2mol电子;水的氢元素的价态由+1价变为0价,2molH2O得2mol电子,故电子转移的方向和数目为:
 ,故答案为:
,故答案为: ;
;(3)钙与钠的性质具有很强的相似性,用钠来制取过氧化钠的反应条件是加热,故以钙为原料制取过氧化钙(CaO2)也是将钙放在空气中加热即可,故反应为:
Ca+O2
| ||
| ||
(4)Na2O2与水反应时,先发生复分解反应生成H2O2和NaOH,然后H2O2分解生成氧气,故在Na2O2与水反应时即体现碱性也体现漂白性;而CaO2与Na2O2的性质有相似性,故在CaO2的水溶液中,也会先生成Ca(OH)2和H2O2,体现碱性也体现漂白性,故滴入酚酞溶液,预期的实验现象可能是溶液先变红色,后褪色;MnO2是H2O2分解的催化剂,故加入少量的MnO2固体,会促进双氧水的分解,有气泡生成,反应为:2H2O2
| ||
| ||
点评:本题考查了物质性质的相似性和递变性,难度不大,应根据钠及其化合物的性质来推测钙及其化合物的性质.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
制备乙酸乙酯的一条合成路线为:下列说法错误的是( )


| A、乙的结构简式为CH3COOCH2CH3 | |||
| B、乙醇与CH3OCH3(二甲醚)互为同分异构体 | |||
| C、反应①属于加成反应 | |||
D、反应②的化学方程式为2CH3CH2OH+O2
|
 A、B、C、D均是前四周期元素组成的单质或化合物,它们之间有如下列转化关系:
A、B、C、D均是前四周期元素组成的单质或化合物,它们之间有如下列转化关系: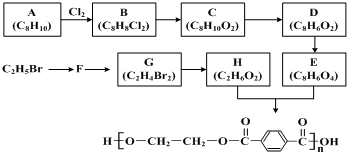
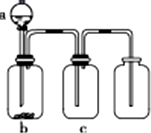 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( )
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( )