ЬтФПФкШн
ЁОЬтФПЁП25ЁцЪБЃЌЯђ50mLКЌга0.1molCl2ЕФТШЫЎжаЕЮМг2molЁЄL1ЕФNaOHШмвКЃЌЕУЕНШмвКpHЫцМгШыNaOHШмвКЬхЛ§ЕФБфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
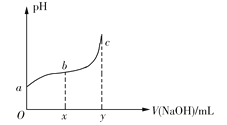
A.ШєaЕуpH=4ЃЌЧвc(Cl)=mc(HClO)ЃЌдђHClOЕФЕчРыЦНКтГЃЪ§ЮЊ![]()
B.Шєx=100ЃЌbЕуЖдгІШмвКжаЃЌc(OH)>c(H+)ЃЌПЩгУpHЪджНВтЖЈЦфpH
C.Шєy=200ЃЌcЕуЖдгІШмвКжаЃЌc(OH)c(H+)=2c(Cl)+c(HClO)
D.bЁњcЖЮЃЌЫцNaOHШмвКЕФЕЮШыЃЌ![]() ж№НЅдіДѓ
ж№НЅдіДѓ
ЁОД№АИЁПC
ЁОНтЮіЁП
AЃЎpH=4ЃЌдђШмвКжаc(H+)=104molЁЄL1ЃЌИљОнЗНГЬЪНЃКCl2+H2O![]() HCl+HClOЃЌHClO
HCl+HClOЃЌHClO![]() H++ClOЃЌШмвКжаc(Cl)=c(ClO)+c(HClO)=mc(HClO)ЃЌc(HClO)=
H++ClOЃЌШмвКжаc(Cl)=c(ClO)+c(HClO)=mc(HClO)ЃЌc(HClO)= ЃЌKa(HClO)=
ЃЌKa(HClO)= =
= =104(m1)ЃЌAЯюДэЮѓЃЛ
=104(m1)ЃЌAЯюДэЮѓЃЛ
BЃЎЩњГЩЕФNaClOжаЕФClOЫЎНтЃЌЕУЕНЕФHClOОпгаЦЏАзадЃЌВЛФмгУpHЪджНВтЖЈЗДгІКѓШмвКЕФpHЃЌBЯюДэЮѓЃЛ
CЃЎcЕуЪБЃЌТШЫЎШЋВПгыNaOHШмвКЗДгІЩњГЩNaClOЁЂNaClЃЌЧвn(Cl)=n(ClO)+n(HClO)ЃЌИљОнЕчКЩЪиКугаЃКn(Na+)+n(H+)=n(OH)+n(Cl)+n(ClO)ЃЌИљОнЮяСЯЪиКугаЃКn(ClO)+n(Cl)+n(HClO)=0.2molЃЌn(Na+)=0.4molЃЌдђгаЃК2n(ClO)+2n(Cl)+2n(HClO)+n(H+)=n(OH)+n(Cl)+n(ClO)ЃЌМДгаЃКc(OH)c(H+)=2c(Cl)+c(HClO)ЃЌCЯюе§ШЗЃЛ
DЃЎbЁњcЖЮЃЌЫцзХNaOHШмвКМгШыЃЌc(HClO)ХЈЖШж№НЅМѕаЁЃЌc(ClO)ж№НЅдіДѓЃЌ ж№НЅМѕаЁЃЌDЯюДэЮѓЁЃ
ж№НЅМѕаЁЃЌDЯюДэЮѓЁЃ
Д№АИбЁCЁЃ

 гІгУЬтзївЕБОЯЕСаД№АИ
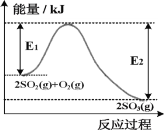
гІгУЬтзївЕБОЯЕСаД№АИЁОЬтФПЁПЮТЖШTЁцЪБЃЌдк3Иі1LЕФКуШнУмБеШнЦїжаЗЂЩњЃКC0(g)+H20(g)= C02(g) + H2(g) ЁїH =-41kJmol-1,ЦфЦ№ЪМЪБЭЖСЯЕФЗНЪНЁЂИїЮяжЪЕФСПМАЦфДяЦНКтЙ§ГЬЬхЯЕШШСПЕФБфЛЏШыЯТБэЫљЪОЃК
ШнЦїБрКХ | Ц№ЪМИїЮяжЪЮяжЪЕФСП/mol | ДяЦНКтЙ§ГЬЬхЯЕШШСПЕФБфЛЏЃЈОљЮЊе§жЕЃЉ | |||
C0 | H20(g) | C02 | H2 | ||
Ђй | 1 | 4 | 0 | 0 | 32.8kJ |
Ђк | 8 | 2 | 0 | 0 | Q1 |
Ђл | 0 | 0 | 1 | 4 | Q2 |
ЯТСаЫЕЗЈжае§ШЗЕФЪЧ
A. ШєОЙ§10sШнЦїЂйжаЗДгІДяЕНЦНКтЃЌдђv(CO)=0.08molL-1s-1
B. ШнЦїЂкКЭШнЦїЂлжаШШСПБфЛЏЃКQ2=Q1=32.8kJ
C. ШєМгШыДпЛЏМСЃЌИФБфСЫИУЗДгІЕФЭООЖЃЌЗДгІЕФЁїHвВЫцжЎИФБф
D. БЃГжЯрЭЌЬѕМўЃЌЯђЦНКтКѓЕФШнЦїЂйжадйМгШы0.2molCO(g)КЭ0.8molCO2(g) ЃЌдђЦНКтВЛЗЂЩњИФБф
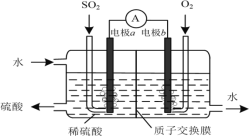
ЁОЬтФПЁПЯТСагаЙиЪЕбщЯжЯѓКЭНтЪЭЛђНсТлЖМе§ШЗЕФЪЧ()
бЁЯю | ЪЕбщВйзї | ЯжЯѓ | НтЪЭЛђНсТл |
A | АбSO2ЭЈШызЯЩЋЪЏШяЪдвКжа | зЯЩЋЯШБфКьКѓЭЪЩЋ | SO2ОпгаЦЏАзад |
B | ЯђAgClГСЕэжаЧхМгKIШмвК | АзЩЋГСЕэБфЮЊЛЦЩЋ | ШмЖШЛ§ЃКAgIБШAgClИќаЁ |
C | НЋГфТњNO2ЕФУмБеВЃСЇЧђНўХндкШШЫЎжа | КьзиЩЋБфЧГ | ЗДгІ2NO2 |
D | АбХЈСђЫсЕЮЕНpHЪджНЩЯ | ЪджНБфКь | ХЈСђЫсОпгаЫсад |
A. AB. BC. CD. D