题目内容
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是工业生产硫酸的重要步骤,T℃时该反应过程中的能量变化如图所示:
2SO3(g)是工业生产硫酸的重要步骤,T℃时该反应过程中的能量变化如图所示:
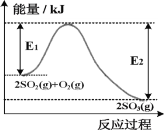
(1)2SO2(g)+O2(g)![]() 2SO3(g)ΔH=___________kJ·mol-1(
2SO3(g)ΔH=___________kJ·mol-1(![]() 含E1、E2的计算式表示)
含E1、E2的计算式表示)
(2)①下列措施不能使该反应速率加快的是___________。
A.升高温度 B.降低压强 C.使用催化剂
②若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是___________。
A.SO3的浓度不再变化
B.SO2与SO3的物质的量相等
C.容器内气体的压强不再变化
D.单位时间内消耗1molO2,同时消耗2molSO2
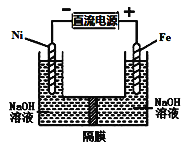
(3)运用电化学原理可生产硫酸,总反应为2SO2+O2+2H2O=2H2SO4,装置如图所示。其中质子交换膜将该原电池分隔成氧化反应室和还原反应室,能阻止气体通过而允许H+通过。
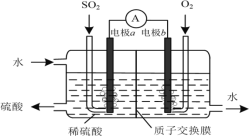
①该电池的负极是___________。(填“电极a”或“电极b”)
②H+通过质子交换膜时的移动方向是___________。
A.从左向右 B.从右向左
③通入O2的电极反应式是___________。
【答案】E1-E2或-(E2-E1) B AC 电极a A O2+4H++4e-=2H2O
【解析】
(1)根据△H=反应物的总键能-生成物的总键能,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=(E1-E2)kJ·mol-1;
2SO3(g) ΔH=(E1-E2)kJ·mol-1;
(2)①A.升高温度,物质的能量增加,活化分子百分数增加,有效碰撞几率增加,化学反应速率增大,A不符合题意;
B.减小体积,降低压强,各物质的浓度减小,有效碰撞几率减小,反应速率减小,B符合题意;
C.使用催化剂,降低活化能,活化分子百分数增加,有效碰撞几率增加,反应速率增大,C不符合题意;
答案选B;
②反应达到平衡时,各物质的浓度不变,且正逆反应速率相等;
A.SO3的浓度不再变化,说明单位时间内生成的SO3和消耗的SO3的物质的量相同,反应达到平衡,A符合题意;
B.达到平衡时,SO2和SO3的物质的量不一定相同,B不符合题意;
C.恒温恒容下,压强之比等于物质的量之比,压强不再变化,说明总物质的量不变,由于反应前后的气体分子数不相等,故当压强不变时,各物质的物质的量不变,反应达到平衡,C符合题意;
D.消耗1molO2,同时消耗2molSO2,均表示正反应速率,无法得知正逆反应速率是否相等,D不符合题意;
答案选AC;
(3)根据总反应,可知SO2化合价升高转化为H2SO4,失去电子,则通入SO2的一极为负极,通入O2的一极为正极;
①根据总反应方程式,SO2转化为H2SO4,化合价升高,失去电子,通入SO2的电极为负极,即电极a;
②在原电池中,阳离子向正极移动,电极b为正极,则H+通过质子交换膜时,由左向右移动,A符合题意;
③O2得到电子与溶液中的H+反应生成水,电极反应式为的O2+4e-+4H+=2H2O。

【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
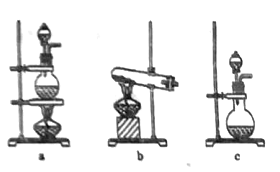
(1)如图中甲为___________滴定管,乙为_________ 滴定管(填“酸式”或“碱式 ”)
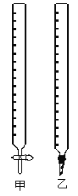
(2)实验中,需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________________________________________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/l。
【题目】硝酸是氧化性酸,其本质是NO![]() 有氧化性,某课外实验小组进行了下列有关NO
有氧化性,某课外实验小组进行了下列有关NO![]() 氧化性的探究(实验均在通风橱中完成)。
氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
⑴写出铜与稀硝酸反应的离子方程式_____。
⑵实验Ⅰ中,铝片作_____(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是_____。
⑶实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是______。
查阅资料:活泼金属与1mol·L-1稀硝酸反应有H2和NH![]() 生成,NH
生成,NH![]() 生成的原理是产生H2的过程中NO
生成的原理是产生H2的过程中NO![]() 被还原。
被还原。
⑷用如图装置进行实验Ⅲ:溶液X为1mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。反应后的溶液中含NH![]() 。生成NH
。生成NH![]() 的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
⑸进一步探究碱性条件下NO![]() 的氧化性,进行实验Ⅳ(如图):
的氧化性,进行实验Ⅳ(如图):
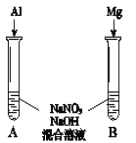
①观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的原因是_____。
②A中生成NH3的离子方程式是______。
⑹将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由______。