题目内容
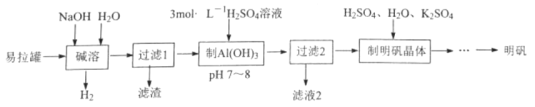
【题目】用废易拉罐(主要成分为Al,少量Fe等)制取明矾的实验流程如下:
(1)铝位于周期表第________周期________族。
(2)检验明矾中K+的方案是:用洁净的铂丝蘸取明矾少许,在酒精灯火焰上灼烧,_______,说明含有K+。
(3)配制100mL 3mol·L-1H2SO4溶液所需的玻璃仪器有:量筒、烧杯、玻璃棒、______和_____。
(4)写出“碱溶”时铝转化为偏铝酸钠的离子方程式: ___________。
【答案】三 IIIA 通过蓝色钴玻璃观察,若有紫色火焰产生 100mL的容量瓶 胶头滴管 2Al+2H2O+2OH-=2![]() +3H2↑
+3H2↑
【解析】
铝和氢氧化钠反应生成偏铝酸钠和氢气,向偏铝酸钠溶液中加入硫酸调节pH为7~8,偏铝酸钠生成氢氧化铝沉淀,向氢氧化铝中加硫酸、硫酸钾溶液,蒸发结晶得到明矾。
(1)铝是13号元素,铝原子有3个电子层、最外层有3个电子,铝位于周期表第三周期IIIA族;
(2)钾的焰色为紫色,检验明矾中K+的方案是:用洁净的铂丝蘸取明矾少许,在酒精灯火焰上灼烧,通过蓝色钴玻璃观察,若有紫色火焰产生,说明含有K+;
(3)配制100mL 3mol·L-1H2SO4溶液,计算需要浓硫酸体积后,用量筒量取所需要体积的浓硫酸,在烧杯中稀释,用玻璃棒不断搅拌,冷却后将溶液用玻璃棒引流转移到100mL容量瓶中,洗涤烧杯和玻璃棒2-3次,洗涤液全部转移到容量瓶,定容时,液面离刻度线1~2cm时用胶头滴管逐滴滴加到凹液面最低处与刻度线相切,摇匀后装瓶,所以用到的玻璃仪器:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管。
(4) “碱溶”时铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2H2O+2OH-=2![]() +3H2↑;
+3H2↑;

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和②B. ②和④C. ③和④D. ①和③
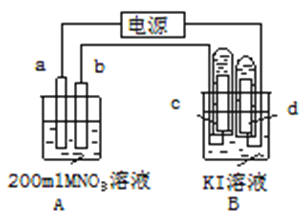
【题目】硝酸是氧化性酸,其本质是NO![]() 有氧化性,某课外实验小组进行了下列有关NO
有氧化性,某课外实验小组进行了下列有关NO![]() 氧化性的探究(实验均在通风橱中完成)。
氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
⑴写出铜与稀硝酸反应的离子方程式_____。
⑵实验Ⅰ中,铝片作_____(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是_____。
⑶实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是______。
查阅资料:活泼金属与1mol·L-1稀硝酸反应有H2和NH![]() 生成,NH
生成,NH![]() 生成的原理是产生H2的过程中NO
生成的原理是产生H2的过程中NO![]() 被还原。
被还原。
⑷用如图装置进行实验Ⅲ:溶液X为1mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。反应后的溶液中含NH![]() 。生成NH
。生成NH![]() 的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
⑸进一步探究碱性条件下NO![]() 的氧化性,进行实验Ⅳ(如图):
的氧化性,进行实验Ⅳ(如图):
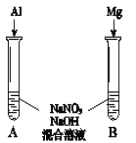
①观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的原因是_____。
②A中生成NH3的离子方程式是______。
⑹将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由______。