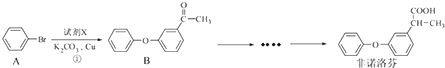
题目内容
1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA(判断对错)
考点:离子化合物的结构特征与性质
专题:化学键与晶体结构
分析:Na2O2的电子式为 ,Na2O的电子式为
,Na2O的电子式为 ,以此来解答.
,以此来解答.
 ,Na2O的电子式为
,Na2O的电子式为 ,以此来解答.
,以此来解答.解答:
解:由Na2O2的电子式为 ,Na2O的电子式为
,Na2O的电子式为 可知,1 mol Na2O中含3mol离子,1molNa2O2中含3mol离子,则1 mol Na2O和Na2O2混合物中离子为3mol,即含有的阴、阳离子总数是3NA ,故答案为:对.
可知,1 mol Na2O中含3mol离子,1molNa2O2中含3mol离子,则1 mol Na2O和Na2O2混合物中离子为3mol,即含有的阴、阳离子总数是3NA ,故答案为:对.
 ,Na2O的电子式为
,Na2O的电子式为 可知,1 mol Na2O中含3mol离子,1molNa2O2中含3mol离子,则1 mol Na2O和Na2O2混合物中离子为3mol,即含有的阴、阳离子总数是3NA ,故答案为:对.
可知,1 mol Na2O中含3mol离子,1molNa2O2中含3mol离子,则1 mol Na2O和Na2O2混合物中离子为3mol,即含有的阴、阳离子总数是3NA ,故答案为:对.
点评:本题考查离子化合物的结构特征,把握物质的电子式、离子键及物质的构成为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列应用不涉及氧化还原反应的是( )
| A、Na2O2用作呼吸面具的供氧剂 |
| B、工业上电解熔融状态的Al2O3制备Al |
| C、工业上利用热纯碱溶液清洗油污 |
| D、用焰色反应鉴定是否有钾元素存在 |
最近,美国普度大学的研究人员开发出一种利用铝镓合金加水制造氢气的新工艺.这项技术具有广泛的能源潜在用途,包括为汽车提供原料、潜水艇提供燃料等.该技术通过向铝镓合金注水,铝生成氧化铝,同时生成氢气.合金中镓(Ga)是关键成分,可阻止铝形成致密的氧化膜.下列关于铝、镓的说法正确的是( )
| A、铝、镓合金与水反应后的物质可以回收利用冶炼铝 |
| B、铝的金属性比镓强 |
| C、铝镓合金的熔点比铝低 |
| D、Ga(OH)3与Al(OH)3性质相似,能与NaOH溶液反应 |
能在溶液中大量共存的一组离子是( )
| A、H+、Na+、AlO2─、HCO3─ |
| B、Ba2+、NH4+、CO32-、Cl─ |
| C、K+、Fe2+、OH─、SO32─ |
| D、Na+、Ba2+、OH─、NO3─ |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A、
| ||
| B、0.1mol?L-1Na2CO3 溶液:K+、Ba2+、NO3-、Cl- | ||
| C、0.1mol?L-1FeCl3 溶液:K+、NH4+、I-、SCN- | ||
| D、使甲基橙变红色的溶液:K+、Al3+、Cl-、NO3- |